Figueroa-Gordon M1*, Especialista en Odontología Operatoria y Estética
Alonso, Guillermina3, Doctora en Ciencias.
Acevedo AM2, MSc, PhD
1Profesor Asistente, Cátedra de Odontología Operatoria, Facultad de Odontología, Universidad Central de Venezuela
2Instituto de Investigaciones Odontológicas "Raúl Vincentelli", Facultad de Odontología, Universidad Central de Venezuela.
3Instituto de Biología Experimental, Facultad de Ciencias, Universidad Central de Venezuela.
Autor de Correspondencia. Mercedes Figueroa GordónCátedra de Odontología Operatoria, Facultad de Odontología.UCV E-mail: [email protected]
Resumen |
La manifestación de la caries dental está mediada por mecanismos complejos que son iniciados por factores, entre los que se incluyen genéticos, conductuales, ambientales y microbianos(1). En el caso de los factores microbianos, la presencia de bacterias es fundamental para el inicio y progresión de las lesiones de caries, sin bacterias no hay lesión(2). De hecho se trata de una enfermedad infecciosa polimicrobiana(3,4) donde cada especie bacteriana individual puede contribuir colectivamente a la cariogenicidad total de la biocomunidad de la placa dental (biopelícula dental) asociada a caries(5,6). Por ello, es importante entender el rol que juegan especies bacterianas específicas en la progresión de la caries dental.
En los humanos, durante los primeros años de vida, los microorganismos cariogénicos colonizan la biopelícula dental, y en presencia de condiciones ambientales favorables, estos microorganismos pueden proliferar induciendo el inicio de la enfermedad(7).
Cuando analizamos la progresión de una lesión de caries podemos identificar diferentes estadios o etapas de avance. La primera etapa clínicamente visible corresponde a la lesión inicial observada a nivel macroscópico como una mancha blanca y la etapa mas avanzada es observada como una cavidad profunda, con dentina expuesta, que puede extenderse hasta la pulpa. (Figura 1 y 2).
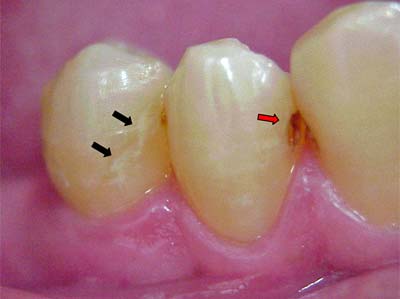
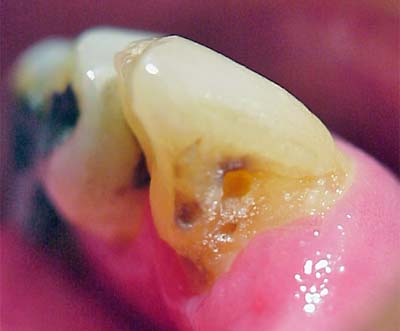
Al determinar la presencia de ciertas especies bacterianas en cada etapa de avance de la lesión, se ha podido evidenciar que algunas especies bacterianas predominan sólo en las etapas iniciales, y otras predominan exclusivamente en las etapas avanzadas de la lesión. Este hecho demuestra una sucesión microbiana a lo largo del progreso o avance de la lesión, que puede estar mediado por la dieta y otros factores. Cada lesión de caries representa un ecosistema único, donde las especies microbianas presentes conforman una biopelícula, y en el que ocurren interrelaciones de sinergismo y antagonismo que determinan la presencia y el crecimiento de microorganismos oportunistas más virulentos y la inhibición de microorganismos residentes poco virulentos(5,7).
En esta revisión se analizará el papel que juegan los principales microorganismos que han sido reportados en las diferentes etapas de progresión de la lesión, así como los factores de patogenicidad que aceleran el proceso de desmineralización y desproteinización (proteolítico), implicados en el proceso de caries sobre los tejidos dentarios.
Para el inicio y progresión de la lesión de caries es esencial que las especies bacterianas involucradas tengan la habilidad de producir ácido (acidogénicas) y tolerar un medio de pH bajo (acidúricas). Además, debe considerarse también la virulencia particular de especies capaces de producir polímeros de sacarosa, y otras especies que aprovechan esta matriz de polímeros para su adherencia y colonización. A través de, este mecanismo estas últimas especies estarían involucradas en el inicio de la lesión de caries dental(2). La placa dental asociada a caries dental contiene altas proporciones de bacterias acidogénicas y acidúricas en comparación con la placa dental asociada a sujetos libres de caries dental(2,8).
Estudios realizados desde 1890, utilizando métodos de cultivo microbiológicos convencionales, demostraron que Streptococos mutans y Lactobacillus estaban asociados a caries dental(9, 10, 11, 12). Cabe destacar que los estudios que soportaron estas evidencias se basaban en el uso exclusivo de medios de cultivo selectivos y no selectivos, originando el crecimiento de un número limitado de especies bacterianas presentes, y no ofrecían la información completa de aquellas especies bacterianas no cultivables presentes, que podían llegar a representar las especies mas prevalentes o numerosas. Gracias a los estudios recientes, que han empleado métodos moleculares de identificación bacteriana, entre los que se destacan la Reacción en Cadena de la Polimerasa (RCP), se ha revelado que las especies bacterianas implicadas en el desarrollo de la caries dental son mas complejas y variadas que la simple presencia exclusiva de S.mutans y Lactobacillus(13).
Microorganismos bucales asociados a caries dental
A medida que la lesión de caries progresa, se da una transición de bacterias anaerobias facultativas Gram-positivas, que predominan en la etapas iniciales de la lesión, a bacterias anerobias estrictas Gram-positivas y Gram-negativas que predominan en lesiones de caries avanzadas(14). Los factores que determinan esta sucesión microbiana son desconocidos(15). Entre las bacterias asociadas con el inicio, progresión o avance de la lesión de caries dental citamos:
Streptococcus
Son cocos Gram positivos, dispuestos en cadenas cortas de 4 a 6 cocos o largas, los cuales miden de 0,5 a 0,8 μm de diámetro, anaerobios facultativos, comprenden parte de la flora microbiana residente de la cavidad bucal y vías respiratorias altas, pero también son patógenos oportunistas en enfermedades humanas como la caries dental y la endocarditis infecciosa, entre otras(16).
En la cavidad bucal se han aislado Streptococcus mutans, Streptococcus sobrinus, Streptococcus salivarius, Streptococcus parasanguinis, Streptococcus sanguinis (Streptococcus sanguis), Streptococcus cristatus, Streptococcus oralis, Streptococcus mitis, Streptococcus constellatus, Streptococcus gordonii, Streptococcus anginosus y Streptococcus oligofermentans(17, 18, 19, 20). De todas estas especies S Streptococcus mutans ha sido la más estudiada.
Entre los factores de patogenicidad presentes en Streptococcus mutans, se destacan: a) poder acidógeno, acidófilo y acidúrico(21, 22, 2), b) síntesis de polisacáridos extracelulares de tipo glucanos insolubles y solubles, y fructanos(23), c) síntesis de polisacáridos intracelulares(24), d) capacidad adhesiva por las proteínas salivales, que posibilitan su adhesión a superficies duras en ausencia de glucanos, y capacidad agregativa y coagregativa a través de mutanos, glucosiltransferasas y proteínas receptoras de glucanos y e) producción de bacteriocinas con actividad sobre otros microorganismos(25). La habilidad de S.mutans de sintetizar glucanos insolubles, a partir de la sacarosa de la dieta, a través de las glucosiltransferasas, facilita la formación de la biopelícula dental(16).
Se ha demostrado que S.mutans está implicado en el inicio de la lesión de caries, mediante estudios realizados en animales de experimentación, entre los que se destaca el estudio de Fitzgerald y Keyes(26), en 1960, quienes demostraron el papel de S.mutans como agente microbiano cariogénico en caries experimental en hamsters. También, quedó demostrada la presencia de altos contajes de S.mutans en humanos, en las muestras de placa dental in situ sobre lesiones de caries iniciales de mancha blanca(27). Además, van Houte(16), en 1994, señaló que S. mutans constituye una alta proporción de la flora cultivable antes y durante el inicio de la lesión de caries.
Por otra parte, Becker y col., (17) en 2002, a través de técnicas moleculares de identificación bacteriana, señalaron la presencia de S.mutans en todas las lesiones de caries profundas examinadas, indicando una fuerte asociación de esta especie con lesiones avanzadas de caries. Este hallazgo, contrasta con estudios anteriores donde se emplearon medios de cultivo, como los realizados por Loesche y Syed(11), en 1973, y por Hoshino y col., (28) en 1984, quienes reportaron que S.mutans solo constituye una pequeña parte de la flora cultivable en áreas profundas de dentina cariada. También, se reportaron la presencia, en lesiones de caries profunda, pero en menos cantidades, de S.salivarius, S. parasanguinis y S.constellatus, las cuales se encuentran asociadas con lesiones de caries profunda de caries(17).
Autores como, Berkowitz(29), Kohler y col., (30) van Houte y col., (31) han sugerido a S.mutans como el mayor agente etiológico microbiano en el desarrollo de caries rampante por biberón
En el caso de lesiones de caries radicular, Schûpbach y col., (18) en 1996, encontraron un mayor contaje de S.mutans en lesiones avanzadas que en lesiones iniciales. Mientras que Brailsford y col., (15) en 2001, señalaron que S. mutans constituye una pequeña proporción de la microflora presente en la zona radicular, y que no hay evidencia concluyente que indique que S. mutans inicie o este involucrado en la progresión de lesiones de caries radicular
A pesar de la evidencia que soporta la fuerte asociación de S.mutans con caries inicial y caries avanzada, Loesche y Straffon(32), en 1979, señalaron que la caries dental puede ocurrir en ausencia de S.mutans, asimismo, Kleinberg(33), en 2002, observó que individuos con altos contajes de S.mutans no necesariamente desarrollan lesiones de caries. Por otra parte, Okada y col., (34) y Linquist y col., (35) observaron que S.sobrinus es más acidogénico y más acidúrico que S. mutans, y la coexistencia de ambas especies es un factor determinante en el desarrollo de caries.
Braislford y col., 36 en 2005, notaron asociaciones significativas entre lesiones iniciales de mancha blanca en primeros molares permanentes recién erupcionados y el incremento del contaje de S.oralis, S.mutans y S.salivarius, mientras que la presencia de Actinomyces naeslundii en estas condiciones se relacionó con molares sanos. También, encontraron diferencias en la microbiota presente entre molares con lesión de mancha blanca parcialmente erupcionados y totalmente erupcionados, destacando la presencia de grandes proporciones de S.oralis y S.salivarius en los molares recién erupcionados, mientras que S.mutans fue aislado en grandes proporciones en aquellos molares completamente erupcionados. En este estudio quedó en evidencia que otros microorganismos no S. mutans están asociados al desarrollo de lesiones de caries iniciales en molares permanentes en erupción.
Lactobacillus
Son bacilos Gram-positivos, anaerobios facultativos, acidógenos y acidúricos, pH cercanos a 5 favorecen su crecimiento, así como el inicio de su actividad proteolítica. Algunas cepas sintetizan polisacáridos intra y extracelulares a partir de la sacarosa, pero se adhieren muy poco a superficies lisas, por lo que deben utilizar otros mecanismos para colonizar las superficies dentarias. Entre estos mecanismos podemos mencionar la unión física por atrapamiento en superficies retentivas, tales como: fosas y fisuras oclusales o caries cavitada, coagregación con otras especies bacterianas, constituyendo la biopelícula dental(37, 12, 25).
Hasta mediados de 1940 se consideró a Lactobacillus como el principal agente microbiano causante de la caries dental, luego por el estudio de Hemmens y col., (41) en 1946, quedó demostrado que Lactobacillus colonizaba sobre las lesiones ya formadas, y no predominaba en la placa dental durante las primeras etapas de formación de la lesión, por lo que desde entonces se considera a esta especie bacteriana como un oportunista secundario, que está implicado en la progresión de la lesión de caries y que prevalece en las etapas avanzadas de la misma(16).
De acuerdo a la actividad metabólica sobre los hidratos de carbono, Lactobacillus es clasificado en Grupo I, II y III. Entre el Grupo I se encuentran L.delbrueckii y L.salivarus y son homofermentativos; en el Grupo II, que son heterofermentativos facultativos, se encuentran L.casei, y L.plantarum y en el Grupo III son heterofermentativos estrictos, donde se encuentra L.fermentum y L.oris. En presencia de gluconato se comportan como heterofermentativos estrictos, produciendo acetato, etanol, formato, lactato y CO2. En presencia de glucosa, se comportan como homofermentativos produciendo lactato sin CO2, pero como producen la enzima piruvato-formato liasa, pueden producir acetato, etanol y formato, pero sin CO2(37).
Entre las especies de Lactobacillus aisladas en lesiones de caries dentinaria se distinguen: L.casei, L.paracasei, L.rhamnosus, L.gasseri, L.ultunensis. L.salivarius, L.crispatus, L.fermentum, L.panis, L.nagelli L.delbrueckii y L.gallinarum(38, 39, 40).
En un estudio realizado por Martin y col., (42) en 2002, se identificaron por técnicas de cultivo los microorganismos presentes en 65 lesiones de caries avanzadas en dentina, reportando altos contajes de Lactobacillus en estas muestras. Estos resultados los llevaron a realizar otro estudio, publicado por Byun y col., (38) en 2004, cuyo objetivo fue definir con precisión la diversidad y la cuantificación de Lactobacillus presentes en estas muestras utilizando RCP a tiempo real. Se detectaron 18 filotipos diferentes de Lactobacillus, y el grupo de L.casei que incluye L.casei, L.paracasei y L.rhamnosus fueron las especies con mayor prevalencia, presentes en el 68% de las muestras. Además, todas las muestras contenían al menos tres especies de Lactobacillus. En cuanto a la cuantificación de las especies los resultados mostraron que L. gasseri y L. ultunensis estuvieron presentes en mayor número, sugiriendo una asociación entre estas dos especies y la caries dentinaria avanzada.
Actinomyces
Son bacilos filamentosos Gram positivos, anaerobios y heterofermentativos. Son inmóviles y su tamaño varía entre 1 y 4 m aproximadamente. Producen una mezcla de ácidos orgánicos, como productos finales, tales como: succínico, láctico o acético. Entre los factores que determinan su virulencia se considera la presencia de fimbrias, que contribuyen con fenómenos de adhesión, agregación y congregación y la producción de enzimas proteolíticas como la neuraminidasa, esta última es de gran importancia cuando las lesiones de caries progresan a dentina profunda(43, 44, 37).
En cuanto a los estudios que hacen referencia a la presencia de Actinomyces en lesiones de caries radicular, se ha reportado la presencia de: Actinomyces naeslundii, Actinomyces eriksonii, Actinomyces israelii, Actinomyces odontolyticus, Actinomyces viscosus, Actinomyces georgiae y Actinomyces gerencseriae(18, 45, 46, 47), pero su rol en el inicio y progresión de la lesión de caries no es concluyente(12, 45). En un estudio publicado en 1957, por Howell y col., (48) se demostró que A.viscosus y A.naeslundii están implicados en la formación de lesiones de caries radicular en la dentición humana. Posteriormente, en estudios realizados en animales de experimentación (ratas y hamsters) quedó demostrado el papel de A.viscosus y A.naeslundii como agente microbiano iniciador de lesiones de caries radicular(49, 50, 51).
Actinomyces se encuentra entre los primeros colonizadores de la cavidad bucal en niños. Sarkonen y col.,(52) en 2000, estudiaron la colonización de Actinomyces en niños hasta los 2 años de edad, y examinaron la ocurrencia de la especie en la saliva de 39 niños sanos a los 2, 6, 12, 18 y 24 meses de edad. La frecuencia de la flora total de Actinomyces se incrementó de 31% a 97% a los dos años de edad. A.odontolyticus fue la primera especie colonizadora entre el género que predominó en todas las edades estudiadas, y A.naeslundii fue la segunda en predominar pero después del año de edad. A.odontolyticus colonizó sobre mucosa bucal y ésta no dependió de la erupción dentaria, mientras que en el caso de A.naeslundii se destacó la ausencia de esta especie hasta el año de edad y la colonización de dicho microorganismo depende de la erupción dentaria. En este estudio también se aislaron A.viscosus, A.gerencseriae y A.israelii. Boyar y Bowden(53) en 1985, asociaron la presencia de A.odontolyticus con lesiones de caries en dentición primaria. Además, se detectaron altas cantidades de microorganismos identificados como A.gerencsiare en lesiones iniciales de mancha blanca, en niños en edades comprendidas entre 2 a 8 años, sugiriendo que esta especie interviene en el inicio de la lesión de caries en niños. Esta especie es residente común de la cavidad bucal en niños una vez que han erupcionado los dientes y produce ácido láctico al metabolizar hidratos de carbono por lo que puede ser el blanco para prevenir el inicio de la enfermedad(17).
Schupbach y col., (18) en 1996, estudiaron los microorganismos presentes en lesiones de caries radicular con diferentes grados de severidad. El diseño experimental del estudio permitió observar la correlación de los estados histopatológicamente distinguibles con poblaciones microbianas específicas. Los resultados del estudio demostraron una proporción significativamente mayor de A.naeslundii en lesiones iniciales que en lesiones avanzadas, además destacaron que S.mutans predominó en lesiones avanzadas, y que el contaje de Lactobacillus fue muy bajo en estas mismas lesiones.
Bifidobacterium
Son bacilos anaeróbicos, Gram-positivos, inmóviles, con frecuencia se agrupan en formaciones ramificadas(37), están presentes generalmente en el tracto gastrointestinal sano de humanos y animales(54). En 1974, Scardovi y Crociani(55) describieron especies de Bifidobacterium dentium aislados de caries dental en humanos. Posteriormente, Beerens y col.,(56) en 1957, aislaron de caries dental cepas de Bifidobacterium y las identificaron como B. dentium.
En 1996, Crociani y col.,(57) describieron dos nuevas especies de Bifidobacterium: Bifidobacterium inopinatum y Bifidobacterium denticolens, ambas aisladas de caries dental. Estas dos especies fueron recientemente, reclasificadas de acuerdo a un análisis de la secuencia génica de la proteína de choque térmico 60, basándose en el segmento 16S del ARN ribosomal, en dos nuevos géneros llamados: Scardovia inopinata (B. inopinatum) y Parascardovia denticolens (B.denticolens)(58).
En un estudio reciente publicado en 2006, Modesto y col., (59) analizaron la prevalencia y las especies predominantes pertenecientes al Género Bifidobacterium en caries dental y placa dental humana tomada de superficies dentales libres de caries. Las tres especies aisladas fueron B.dentium, S. inopinata (B.inopinatum) y P. denticolens (B.denticolens), las cuales estuvieron presentes en 13 de 19, y 11 de 15, muestras de caries dental y placa dental, respectivamente. S.inopinata fue la especie más frecuentemente aislada de caries dental, mientras que B.dentium fue la más numerosa en placa dental, mientras que, la prevalencia de P.denticolens fue similar en ambos hábitats. En este estudio queda en evidencia que este Género forma parte de la microflora residente de la cavidad bucal.
Existen pocos estudios que asocian a Bifidobacterium con alguna etapa específica de la progresión de la lesión de caries. Entre los pocos estudios realizados podemos citar el de Becker y col., (17) en 2002, que demuestra la ausencia de esta especie en las lesiones iniciales de caries, pero una alta prevalencia tanto en lesiones cavitadas no profundas como en dentina cariada profunda, siendo esta mayor que S.mutans y más aún que L.fermentum. Bifidobacterium fue el patógeno presente mayoritariamente en lesiones de caries avanzada en este estudio, lo que sugiere la asociación positiva de Bifidobacterium con la progresión de caries dental.
Sin embargo, Bifidobacterium puede jugar un doble papel, en la enfermedad y en la salud, el primero como promotor del proceso cariogénico, al producir ácido láctico, y el segundo en la reducción de la formación de la matriz extracelular de la biopelícula dental por la capacidad de sintetizar de la enzima gluconasa, la cual tiene actividad específica en la hidrólisis del glucán(59, 60).
Prevotella
Se trata de bacilos anaerobios estrictos, Gram-negativos, no esporulados, inmóviles(37), con marcada actividad proteolítica y de hemolisina. En 1990, algunas especies de Bacteroides fueron reclasificadas dando origen al Género Prevotella. Las especies más comunes encontrados en cavidad bucal son Prevotella melaninogénica, Prevotella oralis, Prevotella intermedia, Prevotella buccae, Prevotella nigrescens, Prevotella denticola y Prevotella loeschii. La presencia de Prevotella está asociada a enfermedad periodontal, e infecciones endodónticas, pero en el caso de caries dental no esta claro el papel que juegan en la progresión de la lesión(61, 62, 63).
En el estudio de Schupbach y col., (18) antes mencionado, si bien los microorganismos Gram negativos constituyeron el menor porcentaje de la microbiota presente tanto en lesiones iniciales como en lesiones avanzadas de caries radicular, entre las bacterias Gram negativas presentes se encontraron Prevotella, Selenomonas y Bacteroides. De las especies de Prevotella aisladas en este estudio cabe señalar la presencia de P.buccae en lesiones iniciales y de P.buccae, P.intermedia y P.denticola en lesiones avanzadas de caries.
La presencia de Prevotella en lesiones de caries dentinaria ha sido estudiada con mas detalle a partir de la década de los 90, utilizando técnicas moleculares de identificación bacteriana(64, 42, 65). Nadkarni y col.,(66) en 2004, a través de RCP a tiempo real, demostraron que las lesiones de caries avanzada en dentina conforman un hábitat favorable para el crecimiento de especies de Prevotella no cultivables, pudiendo en algunas lesiones dominar la comunidad polimicrobiana presente en las mismas.
Martin y col., (42) en 2002, cuantificaron las bacterias aisladas de 65 lesiones de caries dentinaria por contaje de colonias y RCP a tiempo real, y correlacionaron el número y tipo de bacterias con patología pulpar. En el caso de Prevotella, esta fue observada en el 91% de las muestras por contaje de colonias y en el 97% de la muestras por RCP a tiempo real, quedando en evidencia la asociación positiva de especies de Prevotella con lesiones de caries avanzadas.
Veillonella
Son diplococos Gram negativos, anaerobios estrictos, inmóviles que conforman parte de la flora residente en cavidad bucal y vías respiratorias altas. La colonización primaria de Veillonella es independiente de la presencia de dientes erupcionados(67). A pesar de que Veillonella ofrece una pobre adherencia directa a los tejidos del hospedero de la cavidad bucal(68), su presencia en grandes cantidades en placa dental subgingival, placa dental supragingival y sobre superficies mucosas bucales(69, 70), se debe a mecanismos de coagregación interbacteriana(71).
La importancia de su presencia en los ecosistemas bucales está relacionada con el mantenimiento de la homeostasis y la capacidad que posean de neutralizar los ácidos producidos por los microorganismos cariogénicos(72). Veillonella no metaboliza los hidratos de carbono, pero si metaboliza el ácido láctico producido por otras bacterias para formar ácido propiónico y ácido acético, ambos ácidos son más débiles que el ácido láctico(72, 73).
La presencia de Veillonella ha sido asociada con salud bucal, ya que se han encontrado contajes inusualmente elevados de esta especie en la cavidad bucal de niños y adultos libres de caries(74). Además, se observó en ratas infectadas simultáneamente con S. mutans, S.sanguis y Veillonella sp índices más bajos de caries, en comparación con ratas monoinfectadas con alguna de estas bacterias(75).
Sin embargo, estos resultados contradicen el estudio in vitro realizado por Noorda y col., (76) en 1988, quienes observaron que la coexistencia de Veillonella y S.mutans favorece una mayor producción de ácido y desmineralización que cuando esta presente S.mutans solo. Este estudio sugiere que la utilización del ácido láctico por parte de Veillonella puede ser un factor importante en el proceso de caries, ya que mantiene las condiciones de este hábitat favorable para la producción de ácidos por comunidad polimicrobiana de la biopelícula dental.
No se conoce si existe una asociación de Veillonella con caries dental, pero Becker y col., (17) en 2002, encontraron niveles relativamente altos de Veillonella en todos los sujetos tanto sanos como con caries y destacaron que los contajes fueron significativamente mas numerosas en lesiones dentinarias profundas que en cualquier otro sitio. Este hallazgo no concuerda con la asociación positiva de Veillonella con sujetos sanos libres de caries, por lo que es pertinente realizar mas investigaciones al respecto.
Microorganismos bucales asociados a sujetos con caries dental y sujetos sanos libres de caries dental.
Entre los estudios mas recientes que han identificado tanto las especies bacterianas implicadas con cada etapa de avance de la lesión de caries como aquellas especies bacterianas que prevalecen en sujetos sanos, podemos citar el de Becker y col., (17) en 2002; Tong y col., (20) en 2003; Corby y col., (1) en 2005; Li y col., (77) en 2006; y Aas y col., (78) en 2005.
Aas y col., 78 determinaron la microflora humana de la cavidad bucal sana a través de técnicas moleculares de identificación bacteriana. Estimaron que el 60 % de los microorganismos presentes en cavidad bucal no son cultivables. Entre los microorganismos reportados en la totalidad de los sitios analizados (dorso de lengua, áreas laterales de lengua, epitelio bucal, paladar duro, paladar blando, placa dental supragingival, placa dental subgingival, vestíbulo anterior maxilar y amígdalas) se encontraron S.mitis, Veillonella y Gemella. S.mitis fue la especie predominante en todos los sitios analizados (tejidos duros y tejidos blandos) y en todos los sujetos (5) del estudio, por lo que se sugiere su asociación con sujetos sanos sin caries, pero al mismo tiempo esta fuertemente asociada con endocarditis infecciosa, especialmente, en pacientes con válvulas protésicas(79). Además la flora bacteriana comúnmente asociada con caries dental y lesiones de caries avanzadas en dentina, representadas por S.mutans, Lactobacillus y Bifidobacterium, no se detectó en la placa dental supragingival y subgingival de estos sujetos sanos.
Becker y col.,(17) compararon las bacterias encontradas en placa dental de 30 sujetos con caries y 30 sujetos sanos, a través de métodos de identificación molecular (RCP), con el objetivo de identificar especies no cultivables y especies no asociadas anteriormente con caries dental. Las muestras de placa dental de los sujetos con caries fueron recolectadas de esmalte sano y de lesiones en varias etapas de progresión (mancha blanca, lesiones cavitadas no profundas y dentina cariada profunda). Para determinar la asociación de especies bacterianas con la severidad de las lesiones de caries, las muestras obtenidas de esmalte sano fueron comparadas con aquellas obtenidas de lesiones progresivamente profundas. Se observaron diferencias significativas en nueve microorganismos. S.sanguinis fue asociada a sujetos sanos y en orden decreciente asociado a caries: A.gerencseriae, Bifidobacterium, S. mutans, Veillonella, S.salivarius, S.constellatus, S.parasanguinis y L.fermentum. Especies de Actinomyces, en particular A. gerencseriae jugaron un papel relevante en el inicio de caries, mientras que Bifidobacterium fue el patógeno reportado mayoritariamente en caries avanzada.
Li y col.,(77) en 2007, evaluaron las diferencias en la diversidad microbiana presente en la placa dental entre un grupo de niños de origen hispano, en edades comprendidas entre 8 y 10 años, con lesiones de caries severa en edad temprana, y un grupo de niños sin caries. En el grupo con caries se observaron 95 especies y en el grupo sin caries 113 especies. Estos resultados sugieren que la diversidad y complejidad de la microbiota en la placa dental es significativamente menor en niños con caries que en niños libres de caries. Por lo que se sugiere que la microbiota bucal asociada a caries dental presenta menor diversidad de especies microbianas, probablemente porque ciertos grupos de microorganismos suplantan o dominan la biopelícula de la placa dental permitiendo la progresión de la lesión de caries.
Corby y col., (1) en 2005, estudiaron por RCP por transcriptasa reversa, las especies bacterianas asociadas con caries dental y con salud dental en un grupo de 204 individuos gemelos, en edades comprendidas entre 1,5 y 7 años de edad. Se analizaron un total de 448 muestras de placa dental, 118 recolectadas de sujetos libres de caries y 330 recolectadas de sujetos con caries. Se diseñaron dos modelos de estudio, en el primer modelo se compararon las bacterias encontradas en la placa dental de sujetos con caries en esmalte intacto sano y en lesiones con diferentes grados de severidad (lesión de mancha blanca, lesión cavitada en esmalte y lesión cavitada en dentina), con bacterias encontradas en la placa dental de sujetos libres de caries. En el segundo modelo se compararon las especies bacterianas encontradas en la placa dental de sujetos libres de caries con las especies bacterianas encontradas en la placa dental de superficies de esmalte sano en sujetos con caries. En ambos modelos hubo coincidencia en cuanto a la abundancia de microorganismos asociados con caries, siendo identificadas bacterias Gram-positivas, tales como: Actinomyces, Lactobacillus y S.mutans, mientras que los sujetos libres de caries presentaron abundancia de otras bacterias tales como: S. parasanguinis, Abiotrophia defectiva, Gemella haemolysans, S.mitis/oralis, Streptococcus cristatus y S. sanguinis.
En este estudio de Corby y col., (1) se encontraron altos contajes de S.mutans en el 90% de los sujetos con caries, mientras que en los sujetos libres de caries esta especie constituyó una de las especies menos numerosas. En el caso de Lactobacillus se encontró con alta frecuencia en sujetos con caries y en un solo sujeto sin caries.
En el caso de Actinomyces, se encontraron con alta frecuencia tanto en sujetos con caries como en sujetos sanos, pero con diferencias estadísticamente significativas entre las especies de Actinomyces presentes. Una especie en particular Actinomyces spp. cepa B19SC fue significativamente mas numerosa en sujetos con caries en comparación con sujetos sanos.
Cabe destacar que en los estudios de Corby y col.,(1) y de Becker y col.,(17) se demostró una asociación positiva de S. sanguinis (anteriormente S.sanguis) con salud bucal, sin embargo esta misma especie esta asociada a endocarditis infecciosa(79).
En 1970, Carlsson y col., (80) estuvieron entre los primeros en describir las características taxonómicas de S. sanguinis en cavidad bucal y observaron que, coloniza en boca una vez ocurrida la erupción dentaria en niños, y que esta colonización precede la colonización de S.mutans. Posteriormente, Caufield y col.,(81) en 1993, señalaron que la colonización de S. sanguinis en cavidad bucal ocurre alrededor de los 9 meses de edad, y la colonización de S.mutans ocurre aproximadamente a los 26 meses de edad. También señalaron que la colonización de ambas especies en boca depende de la presencia de dientes.
Además, la colonización temprana de S. sanguinis y sus elevados niveles en cavidad bucal fueron correlacionados con un retardo de 6 meses en la colonización de S.mutans. Una vez que S.mutans coloniza en la cavidad bucal de los niños, los niveles de S.sanguinis disminuyen, indicando un aparente antagonismo entre estas especies. Se observó también que los niños que no presentaron niveles detectables de S.mutans en saliva, tenían niveles significativamente altos de S.sanguinis en saliva, en comparación con aquellos niños en los cuales se les detectó niveles de S.mutans en saliva. Todos estos hallazgos en conjunto sugieren que la colonización de S.sanguinis puede influir en la sucesiva colonización de S.mutans y esto puede constituir el blanco de un abordaje para controlar la caries dental(82).
Conclusiones
El predominio de S.sanguinis y S.mitis en cavidad bucal se asocia a sujetos sanos libres de caries.
S.mutans se relaciona con el inicio y progresión de las lesiones de caries, aunque su presencia no es indispensable para el desarrollo de la enfermedad, por lo que S.mutans puede no representar un factor etiológico bacteriano determinante.
El predominio de especies de Lactobacillus, Bifidobacterium y Prevotella en las etapas avanzadas de las lesiones de caries, y su ausencia en la biopelícula dental de lesiones iniciales, demuestra que estos microorganismos son oportunistas secundarios, que colonizan la biopelícula de lesiones avanzadas contribuyendo con la progresión de la lesión de caries.
La presencia de Actinomyces en niños se asocia con el inicio de lesiones de caries en dentición primaria, y en adultos con el inicio de lesiones de caries radicular.
La importancia de entender los procesos que conllevan a la sucesión bacteriana durante el desarrollo y progresión de la lesión de caries, así como la identificación de especies iniciadores del signo de la enfermedad, radica en que pueden ser el blanco de diferentes mecanismos terapéuticos para evitar la progresión de la lesión y evitar técnicas invasivas que conllevan al sacrificio de tejido dentario.
Referencias Bibliográficas
|