Maria Correnti(1), Rosalba Gutierrez(2), Marianella Perrone(3), Mayra Avila (4)
(1) Jefe del Laboratorio de Genética Molecular, Instituto de Oncología y Hematología, Ministerio de Salud, Caracas, Venezuela. Profesor Agregado, Jefe del Centro de Biotecnología aplicado a la Odontología, Instituto de Investigaciones Odontológicas Raúl Vincentelli, Facultad de Odontología, Universidad Central de Venezuela, Caracas, Venezuela.
(2) Odontóloga, Estudiante de la Maestría de Medicina Estomatológica, Facultad de Odontología, Universidad Central de Venezuela, Caracas, Venezuela.
(3) Profesor Titular, Jefe del Laboratorio de Microbiología, Instituto de Investigaciones Odontológicas Raúl Vincentelli, Facultad de Odontología, Universidad Central de Venezuela, Caracas, Venezuela.
(4) Bióloga. Laboratorio de Genética Molecular, Instituto de Oncología y Hematología, Ministerio de Salud, Caracas, Venezuela.
Correspondencia: Maria Correnti. IIORV, Facultad de Odontología, UCV, Caracas, Venezuela
Tel: 582126053796
Email: [email protected], [email protected]
RESUMEN |
INTRODUCCIÓN
La Estomatitis Aftosa Recurrente es la afección ulcerativa más frecuente de los tejidos blandos de las mucosas. Estas ulceraciones están caracterizadas por ser dolorosas, superficiales, solitarias o múltiples limitadas a la mucosa no queratinizada. (1,2). Las investigaciones epidemiológicas de la EAR revelan un amplio rango de ocurrencia (5-60%), dependiendo de las características del grupo de estudio y el modo de evaluación (3).
A pesar de la prevalencia de la EAR, su etiología no está clara y resulta un enigma para los investigadores, ya que lesiones clínicas asociadas con gran número de procesos locales y sistémicos muy diferentes, muestran los mismos rasgos histopatológicos (4).
En este sentido varios autores (5, 6, 7) señalan la probable existencia de un fenómeno de citotoxicidad celular dependiente de anticuerpos, que en personas genéticamente predispuestas y en presencia de una serie de factores asociados, desencadenarían las aftas.
El principal apoyo para una base inmunológica se relaciona con alteraciones del número de los subtipos de células T en la sangre periférica en comparación con los controles. Los individuos con EAR muestran una relación alterada de células CD4 y CD8, habiéndose demostrado específicamente un aumento de linfocitos T (CD8) en estos pacientes (8, 9,10).
Actualmente existe mucha atención sobre el papel del endotelio vascular, en el reclutamiento de los infiltrados inflamatorios como el que presenta la EAR. Histológicamente, las lesiones tempranas muestran un denso infiltrado linfocítico perivascular, aún antes de que se desarrolle la úlcera, el cual llega después a ser más difuso y mezclado con el influjo de leucocitos polimorfonucleares, a medida que la lesión de desarrolla.
Las moléculas de adhesión de células endoteliales pueden jugar un papel fundamental en este proceso, incluyendo las moléculas de adhesión de la superfamilia de las inmunoglobulinas: la molécula de adhesión celular vascular-1 (VCAM-1) y la molécula de adhesión intercelular-1 (ICAM-1). Además, las células endoteliales activadas expresando estas moléculas, pueden convertirse en el blanco para el daño citotóxico, contribuyendo a la ruptura del tejido que ocurre en los sitios de la ulceración (11).
Ciertamente, las moléculas VCAM-1 y la ICAM-1 son esenciales para la unión de las células inflamatorias a las células endoteliales. Las formas circulantes de estas moléculas han sido detectadas en un número de procesos de enfermedad vasculítica, de las cuales la EAR presenta algunas características y aunque es una condición aislada, algunas veces está asociada con enfermedades sistémicas como la enfermedad de Crohn, la enfermedad celíaca y es una característica del síndrome de Behçet, una condición en la cual se considera que la vasculitis juega un papel dominante. Esta asociación ha permitido sugerir que un proceso vasculítico puede ser la base de la patogénesis de la EAR (12,13). El objetivo de la presente investigación fue determinar la expresión de las moléculas de adhesión ICAM-1, VCAM-1 y las subpoblaciones de linfocitos T CD4+ y CD8+, en lesiones de pacientes con EAR.
MATERIALES Y MÉTODOS
Se incluyeron 19 pacientes tratados en el Servicio de Clínica Estomatológica de la Facultad de Odontología de la Universidad Central de Venezuela, de los cuales 15 presentaban EAR Menor y 4 tenían EAR Mayor. El tipo de ulceración aftosa fue determinada de acuerdo al criterio de Lehner (1968) (14). Todas las lesiones estaban en la etapa ulcerativa (6-8 días de evolución). Ninguno de los pacientes tuvo tratamiento previo. El grupo control seleccionado al azar, incluyó muestras de encía de diez pacientes sin historia de EAR, los cuales tenían indicadas cirugías periodontales por razones protésicas o estéticas,
El consentimiento informado por escrito fue obtenido de los pacientes y de los representantes de los menores de edad, previo a la toma de las muestras del grupo con EAR, de acuerdo al lineamiento sobre investigación implicando a sujetos humanos. (15)
Los criterios de exclusión fueron los siguientes: embarazo; historia de alguna enfermedad sistémica en la cual la ulceración bucal pudiera ser una característica; pacientes con tratamientos de corticosteroides, drogas inmunomoduladoras o citotóxicas; pacientes con VIH o SIDA.
Las lesiones fueron removidas, usando una técnica estándar para biopsia excisional, bajo anestesia local .Las muestras fueron fijadas en OCT. (Tissue-Tek, Lab-Tek Products, Miles Inc. USA) e inmediatamente congeladas a una temperatura de -70° C hasta su procesamiento. De las muestras tomadas se realizaron cortes histológicos de 4 micras de espesor, los cuales fueron extendidos en láminas de vidrio preparadas con un adhesivo a base Poli-Lisina (PLL) (Sigma Chemical CO, St Louis, MO, USA). Posteriormente, los cortes fueron procesados mediante inmunohistoquímica, por el método Avidina-Biotina Inmunoperoxidasa (16,17). Se utilizaron como anticuerpos primarios, monoclonales para detectar las moléculas de adhesión ICAM-1, VCAM-1, linfocitos T CD4+, y linfocitos T CD8+. (DAKO). La dilución utilizada para cada uno de los anticuerpos fue de 1:50. Se utilizó como anticuerpo secundario IgG biotinilada (BHAM biotinylated horse anti-mouse, Marca VECTOR) y para el revelado la mezcla cromógeno-sustrato constituida por buffer acetato 0,1 M pH 5,3, AEC (solución de 3-amino-9-etil-carbarzole) diluido en dimetilformamida y peróxido de hidrógeno al 3% y se colorearon los cortes con Hematoxilina de Mayer por 1 min. Para el estudio histopatológico de rutina y posterior descripción del infiltrado, las muestras fueron teñidas con Hematoxilina y Eosina.
La cuantificación de los linfocitos T CD4+ y CD8+ fue realizada utilizando un microscopio de luz y un monitor, el cual estaba calibrado para determinar el número de células por mm2 a una magnificación de 40x. Se consideraron como positivas solo las células que presentaban núcleo coloreado de rojo parduzco (17).Para las moléculas de adhesión ICAM-1 y VCAM-1 se observaron las láminas al microscopio óptico y para el análisis de la expresión se consideraron dos variables: localización e intensidad de la inmunotinción. (17). Con respecto a la localización del marcaje se evaluaron de forma separada: epitelio y corion. Para la ICAM-1 se consideró, endotelio del corion, infiltrado sub-epitelial y epitelio y para la VCAM-1 se determinaron las variables endotelio del corion e infiltrado sub-epitelial.
En cuanto a la intensidad de la inmunotinción para la ICAM-1 y VCAM-1, esta fue clasificada semicuantitativamente usando 4 puntos de la escala descrita por Messadi y col. (1987) (18), la cual fue modificada para este estudio: 0= no hay inmunotinción, 1= inmunotinción débil, 2= inmunotinción moderada, 3= inmunotinción fuerte o intensa.
La inmunotinción de la ICAM-1 en los queratinocitos también fue clasificada semicuantitativamente de acuerdo al criterio utilizado por Norris y col. (1991) (19), adaptada para esta investigación: 0= no hay inmunotinción en los queratinocitos, 1= inmunotinción débil en los queratinocitos basales, 2= inmunotinción moderada en los queratinocitos basales, 3= inmunotinción fuerte en los queratinocitos basales y hasta la mitad del epitelio.
Para el análisis estadístico los datos fueron procesados utilizando el programa SPSS 11.0, Para las variables cuantitativas: Media aritmética y la desviación estándar y para las variables cualitativas: la Mediana y el porcentaje. La comparación de los datos obtenidos fue realizada mediante la prueba t de Student, Kruskal-Wallis y la prueba Chi-cuadrado. Se consideró como nivel de significancia estadística p<0.05.
RESULTADOS
Se evaluaron 29 individuos de los cuales 19 pacientes presentaban EAR y 10 individuos sanos que conformaron el grupo control. Con respecto a la edad, se encontró que el promedio de edad del grupo con lesión fue de 39.58±9.33 años (X±EMS). El grupo control presentó un promedio de 34.40±11.47 años (X±EMS).
Al agrupar los pacientes por género, el grupo con lesión comprendió 19 pacientes, de los cuales 13 fueron del género femenino (68.42%) y 6 del masculino (31.58%). En el grupo control 8 fueron del género femenino (80%) y 2 del masculino (20%).
En esta investigación se presentaron dos de los tres tipos de Estomatitis Aftosa Recurrente: el tipo Mayor (EAR Mayor) y la Menor (EAR Menor). No se presentó ningún caso del tipo Herpetiforme. En cuanto a la distribución de los tipos de EAR: el 78.95% de casos fueron de la EAR tipo Menor (15/19) y el 21.05% de los casos de la EAR tipo Mayor (4/19).
Referente a los hábitos del grupo con lesión, solo un paciente (1/19) manifestó el consumo diario de alcohol y otro paciente refirió el consumo frecuente de gomas de mascar (chicle) con sabor a menta y canela, representando el 20.0% (2/19).
Los resultados del estudio histopatológico de las muestras con EAR reportaron úlcera crónica inespecífica. El diagnóstico microscópico de todas las lesiones fue similar, y se describe como ausencia total o parcial del epitelio, infiltrado inflamatorio subepitelial y en la lámina propia predominio de linfocitos y plasmocitos, con algunos eosinófilos. También se observó presencia de material fibrinoide, necrosis y la base de la úlcera con abundantes leucocitos polimorfonucleares neutrófilos
En relación al estudio inmunohistoquímico, para los subtipos linfocitarios los valores fueron expresados como los promedios de las células por mm2 el error estándar de la media (X ESM). El grupo con lesión presentó un valor de densidad promedio de linfocitos T CD8+ y TCD4+ mayor al del grupo control y la diferencia entre ambos valores fue estadísticamente significativa (p < 0.05) (Tabla N° 1).
Subpoblaciones Linfocitarias T CD4+ y T CD8+ en Lesiones de Pacientes con Estomatitis Aftosa Recurrente y en Control Sano.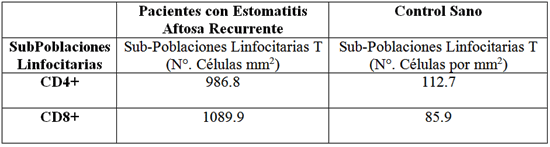
Se destacó la presencia de un gran número de linfocitos T CD8+ en el corion de los tejidos (Fig. Nº 1) y en el epitelio. En los tejidos de los pacientes con EAR, se presentó gran cantidad de linfocitos T CD4+ localizados en el corion, pero escasas células en el epitelio (Fig. Nº 2).
Linfocitos T citotóxicos CD8+ en tejido de Estomatitis Aftosa Recurrente 40X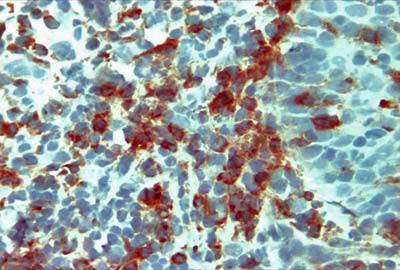
Linfocitos T ayudadores-inductores CD4+ en tejido de Estomatitis Aftosa Recurrente 40X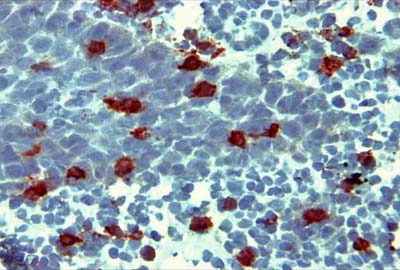
Con respecto al inmunopositividad de la molécula de adhesión ICAM-1, los resultados están representados en la Tabla N° 2, donde es posible observar que tanto a nivel de las células endoteliales, como en el infiltrado celular y en el epitelio, se encontraron diferencias estadísticamente significativas entre los valores del grupo con lesión y el sano (p < 0.05). Se observó un fuerte marcaje en el corion-infiltrado seguido del corion-endotelio y epitelio. La expresión de la ICAM-1 en los queratinocitos de los tejidos de los pacientes con EAR, fue un rasgo prominente y mostró la característica "malla de gallinero", apariencia de inmunotinción positiva, de la membrana del queratinocito de la capa basal. (Fig. N° 3). Con respecto a la expresión de VCAM-1 los resultados están representados en la Tabla N° 3, observándose una mayor expresión de esta molécula en los individuos con lesión con respecto a los del grupo control; siendo esta diferencia estadísticamente significativa. Es posible evidenciar una inmunotinción similar en el corion-infiltrado y en el corion-epitelio. (p<0.05). (Fig. N° 4)
Expresión de las Moléculas de Adhesión ICAM-1 en Tejidos de Pacientes con Estomatitis Aftosa Recurrente y Mucosa Bucal del Grupo Control Sano.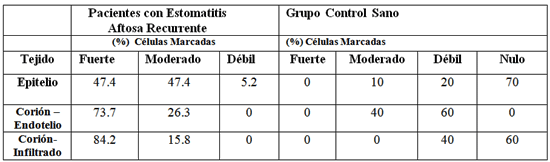
Expresión de las Moléculas de Adhesión VCAM-1 en Tejidos de Pacientes con Estomatitis Aftosa Recurrente y Mucosa Bucal del Grupo Control Sano.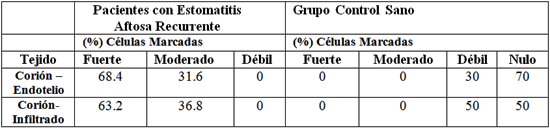
Expresión de la Molécula de Adhesión ICAM-1 en tejido de Estomatitis Aftosa Recurrente 40X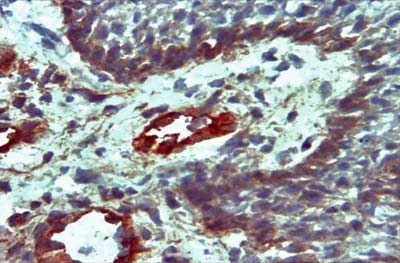
Expresión de la Molécula de Adhesión VCAM-1 en tejido de Estomatitis Aftosa Recurrente 40X 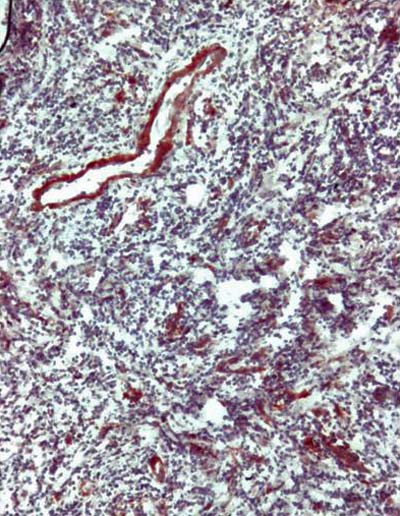
V. DISCUSIÓN
En la presente investigación se evaluaron 19 pacientes con EAR, el 68.4% pertenecían al género femenino y el 31.6% al masculino, con una proporción de 2.2:1. Otros estudios han demostrado el predominio de estas lesiones en el género femenino (20, 21, 22). Existen reportes de prevalencia que exponen que los hombres y las mujeres están igualmente afectados. (23, 24). Con respecto a la edad, el rango de los pacientes con EAR comprendió edades desde los 9 años hasta 82 años, siendo el promedio de 39.58±9.33 años. Resultados similares han sido reportados en otras investigaciones (24).
De acuerdo a los tipos de Estomatitis Aftosa Recurrente en el grupo estudiado, el 78.95% de los casos fueron del tipo Menor y solamente se presentaron 4 casos del Mayor (21.05%). Los resultados obtenidos son similares a otros estudios (25, 26, 27, 28), en los cuales la EAR Menor era el subtipo más común. Al analizar los hábitos psicosociales en nuestra población, una minoría de pacientes manifestó tenerlos, entre ellos solo un paciente manifestó ingerir el consumo diario de alcohol y otro paciente refirió el uso frecuente de gomas de mascar (chicle) con sabor a menta y canela. El papel del consumo de bebidas alcohólicas en la etiología de la EAR es difícil de establecer y en este estudio no es posible establecer una asociación entre la presencia de lesiones y el uso de alcohol. Referente al hábito de masticar chicle, algunos investigadores han postulado que ciertos aditivos pueden actuar como alergenos y precipitar la aparición de la enfermedad (29.30). Sin embargo, otros estudios no han podido demostrar cualquier asociación entre la EAR y ciertos alimentos. (31)
Con respecto a los linfocitos T CD4+ y CD8+ en las muestras de tejido con EAR y en el grupo control sano, los resultados demuestran un aumento estadísticamente significativo de estas células en las lesiones de EAR específicamente de los CD8+, en relación con los controles sanos, datos que están en concordancia con algunos reportes (32,33). Existen estudios que muestran una proporción mayor de linfocitos T CD4+ que CD8+ (34). Ha sido propuesto que los sujetos con EAR, muestran un aumento en la citotoxicidad celular dependiente de anticuerpo en la etapa inicial de la enfermedad (35,36). Otros autores (37) han demostrado que los neutrófilos sanguíneos periféricos, juegan un papel importante en la fagocitosis y en la eliminación del material antigénico o productos del tejido dañado en esta entidad Estos datos apoyan la hipótesis de un desequilibrio en la fracción de las células T en sangre periférica como también en los subtipos de linfocitos T.
De esta forma, algunos estudios realizados en sangre periférica de pacientes con EAR (38, 39). han reportado los porcentajes de los linfocitos T CD4+ periféricos consistentemente reducidos en estos pacientes. Pareciera que la disminución de estas células periféricas también está reflejada en la mucosa no afectada.
En referencia a los niveles de los linfocitos T CD8+ periféricos, algunas investigaciones (39, 40) han demostrado aumentados los porcentajes de dichas células en los pacientes con EAR, con una tendencia a un mayor incremento durante la etapa ulcerativa inicial. En cuanto a la relación CD4+/CD8+ ha sido reportado por los mismos autores estar reducida en los pacientes con EAR, datos que coinciden con esta investigación. De esta manera, los cambios de la proporción de los linfocitos T CD4+/CD8+ periféricos, posiblemente también están presentes en la mucosa bucal.
En el presente trabajo observamos la expresión de las moléculas de adhesión ICAM-1 y VCAM-1 significativamente elevadas en las lesiones de EAR en comparación con los controles. La expresión de la molécula ICAM-1 en los queratinocitos de las lesiones con EAR, fue un rasgo prominente y mostró la característica "malla de gallinero", apariencia de inmunotinción positiva de la membrana del queratinocito de la capa basal. La ICAM-1 no se expresa normalmente en esta área, por lo que debe existir un proceso inflamatorio para que sea expresada. (41).Nuestros resultados están en concordancia con algunos estudios (42), que observaron que los queratinocitos expresaron fuertemente la molécula ICAM-1 en las lesiones de la EAR, aunque son diferentes de los obtenidos por otros investigadores (43), quienes reportaron solo su presencia en las células de la capa basal.
Se ha reportado que la expresión de ICAM-1 en los queratinocitos puede ser un fenómeno secundario a la infiltración linfocítica, y puede ayudar a retener o acumular a los linfocitos en el epitelio de la mucosa bucal, por lo que su expresión, puede ser importante en la patogénesis de la EAR, ya que al persistir la adhesión de los linfocitos T, puede mediar su migración intra-epitelial y la retención de los mismos, contribuyendo a exacerbar el proceso inflamatorio. (44,45).
Esto quedaría reforzado por los resultados obtenidos en el grupo control, donde estas células expresaron la ICAM-1 en muy pocas muestras de mucosa normal, las cuales estaban cercanamente asociadas con vasos sanguíneos, y solamente de manera moderada y débil en algunos queratinocitos.
La expresión de estas moléculas también puede jugar un papel más directo en la ruptura epitelial y en la formación de la úlcera. Las células natural killer (NK) y los linfocitos T citotóxicos CD8 positivos, son capaces de atacarlos como blanco y, destruirlos directamente, debido a su capacidad para unirse a la ICAM-1 expresada en dicha célula (46,47). A este respecto, es interesante observar que los linfocitos T intraepiteliales son predominantemente CD8-positivos en la EAR ulcerativa, como ha sido demostrado en la mayoría de las lesiones de este estudio, por lo que el desarrollo de la úlcera podría ser una consecuencia directa de la lisis de los queratinocitos, particularmente si la expresión ICAM-1 se extiende a través de todo el grosor del epitelio.
Al evaluar la expresión de la ICAM-1 en otras localizaciones, se observó un fuerte inmunomarcaje en el endotelio de los vasos sanguíneos y en las células del infiltrado celular del corion de las lesiones con EAR. Estos resultados están en concordancia con los reportados por otros autores (49,50) Todos los individuos del grupo control también expresaron la molécula de adhesión ICAM-1 en las células endoteliales, pero a diferencia de los tejidos de los pacientes con EAR, la expresión fue débil y moderada. Además, en este mismo grupo, se encontró un escaso infiltrado celular débilmente marcados en cercanía a vasos sanguíneos. La expresión de estas moléculas sobre las células endoteliales que revisten a los vasos, parece ser esencial para la migración de los leucocitos dentro de los tejidos, tanto en la vigilancia inmunológica de la mucosa normal, como en los infiltrados inflamatorios.
Los resultados obtenidos en relación a la molécula de adhesión VCAM-1, también mostraron aumentada su expresión en las lesiones de la EAR, en comparación con el grupo control sano. La característica más notable fue la frecuencia e intensidad de su expresión en las células endoteliales observadas en las lesiones, mientras que solo estaba expresada débilmente, en las células endoteliales de algunas biopsias de las muestras de la mucosa normal. Estos datos coinciden con otros reportes (48).
Se ha demostrado que la VCAM-1 esta solo mínimamente expresada, en las células endoteliales de la piel normal, lo que demuestra su importancia en mediar la adhesión a los linfocitos, monocitos, basófilos y eosinófilos, así como su subsecuentes migración dentro de los tejidos (50, 51). También en los individuos con lesión se observó la mayor expresión de la VCAM-1 en la zona del infiltrado celular. Es por lo tanto probable, que la fuerte expresión de esta molécula sobre las células endoteliales que revisten a los vasos sanguíneos en la EAR, juegue un papel importante en el reclutamiento del infiltrado en estas lesiones que consisten predominantemente de linfocitos.
Esta sugerencia es sustentada por nuestros resultados comparándolos con las muestras de la mucosa normal, donde solamente la mitad de ellos expresó débilmente la molécula VCAM-1 en el corion. Los resultados del presente estudio sugieren la implicación de los linfocitos T, y por tanto, de una respuesta inmune mediada por células activadas en la patogénesis de la EAR, así como de las moléculas de adhesión, que jugarían un papel importante en las interacciones celulares, en la inmunidad y en el reclutamiento del infiltrado celular inflamatorio en esta lesión, que consiste predominantemente de linfocitos, pudiéndose convertir en blanco para el daño citotóxico y contribuyendo de esta forma, a la ruptura del tejido que ocurre en los sitios de ulceración.
BIBLIOGRAFIA
|