Recibido para Arbitraje: 02/12/2015
Aceptado para Publicación: 07/01/2016
El objetivo de este trabajo fue determinar la presencia de bacterias periodontopatogenas en 20 pacientes con periodontitis crónica. Las muestras de los sacos periodontales (≥ 5 mm) de los pacientes con periodontitis fueron tomadas con conos de papel y transportadas en el medio de Caldo Tioglicolato pre-reducido y luego sembradas en Agar Sangre para el aislamiento de anaerobios. La identificación se realizó a través del sistema VITEK®2. Porphyromonas. gingivalis (26%), Prevotella. intermedia (17%) y Veillonella spp (9%) fueron las bacterias identificadas en este estudio.
Palabras clave: Periodontitis Crónica, Bacterias periodontopatógenas, Prevotella intermedia, Porphyromonas gingivalis.
The objective of this study was to determine the presence of periodontal pathogen bacteria in 20 patients with chronic periodontitis. The periodontal pocket samples (≥ 5 mm) the patients with periodontitis were taken by means of paper cones and transported in pre-reduced Thioglycolate Broth and them were streaked on blood agar to isolate anaerobic bacteria. The identification was carried out by VITEK®2 enzymatic system. P. gingivalis (26%), P. intermedia (17%) y Veillonella spp (9%) were the bateria identificated in this studied.
Key words: periodontopathogenic bacteria, chronic periodontitis, Prevotella intermedia, Porphyromonas gingivalis.
CORRRESPONDENCIA: [email protected]
El término de Periodontitis, incluye enfermedades inflamatorias que conducen a la destrucción del aparato de sostén del diente. Estas enfermedades han sido relacionadas con una variedad de microorganismos responsables de la iniciación y progresión de la enfermedad1. Desde el siglo pasado se han acumulado una cantidad de evidencias sobre la etiología de la periodontitis, lo que ha dado lugar a denominar a algunas bacterias como patógenos periodontales, los cuales están relacionados con la iniciación y progresión de la enfermedad. A pesar que hay muchas bacterias que se aíslan en los sacos periodontales, solo un pequeño porcentaje de ellas se consideran etiológicamente importantes. El grupo de Bacilos Anaerobios Gram Negativos mayormente relacionados en la etiología de la enfermedad periodontal comprende los Géneros Porphyromonas, Prevotella, Bacteroides y Fusobacterium. La clasificación de estas bacterias ha sido difícil y por ello a lo largo de los años han emergido numerosas reclasificaciones taxonómicas, que posiblemente continúen en el futuro2. A partir de 1960, las investigaciones realizadas dieron a conocer la existencia de microorganismos específicos en la biopelícula subgingival de pacientes con periodontitis, diferentes a los microorganismos hallados en la biopelícula subgingival de pacientes periodontalmente sanos. Entre los años 1970 y 1980, se hicieron grandes esfuerzos por clarificar la naturaleza infecciosa de la periodontitis, determinando que el factor etiológico de la enfermedad es un grupo de bacterias, predominantemente Gram negativas, anaeróbicas que colonizan el área subgingival. Sobre la base de que algunos autores definen a la periodontitis como un proceso infeccioso relacionado con la acumulación de biopelícula dental, así como también con la presencia de microorganismos patógenos, siendo las bacterias anaerobias las principalmente involucradas se han realizado diferentes estudios con el objetivo de mejorar las técnicas para cultivar e identificar dichos patógenos3,4. En 1990, se concluyó que, aunque las bacterias son esenciales, no son suficientes para que se pueda desarrollar la enfermedad5. En 1996, en el Taller Mundial sobre factores microbiológicos y patogenia en la Periodontitis, se consideró que la mayoría de las periodontitis estaban asociadas a tres bacterias en particular: Porphyromonas gingivalis, Tannerella forsythia (Bacteroides forsythus) y Aggregatibacter actinomycetemcomitans (Actinobacillus actinomycetemcomitans)6. Estudios posteriores indican que la enfermedad periodontal ocurre por la interacción de varios factores, entre los que se encuentran, ambientales, genéticos, microbiota periodontopatogena y el hospedero susceptible. Esta afirmación ha sido corroborada algunas investigaciones que reportan que la frecuencia relativa de cada microorganismo varía entre poblaciones de diferentes orígenes geográficos, concluyendo que su prevalencia cambia entre individuos del mismo ambiente y entre distintas etnias y países7,8. La evidencia científica actual ha asociado a P. gingivalis con el inicio y severidad de la periodontitis crónica y A. actinomycetemcomitans, ha sido ampliamente asociado a periodontitis agresiva9,10. Por lo antes expuesto y por el número creciente de pacientes que acuden a la consulta del Periodoncista con esta enfermedad, objetivo del estudio fue detectar bacterias periodontopatogenas en muestras de biopelícula dental subgingival de los sacos periodontales, provenientes de pacientes con periodontitis crónica que asisten a la Clínica del Postgrado de Periodoncia de la Universidad Central de Venezuela.
Los sacos periodontales seleccionados para la toma de la muestra en los pacientes, se aislaron con rollos de algodón, removiendo previamente la biopelícula supragingival. Se utilizaron conos de papel número 30, estandarizados y esterilizados, para tomar las muestras dentro de los sacos periodontales con una profundidad de saco ≥ a 5 mm., por 30 segundos, e inmediatamente cada cono de papel se colocó en un medio de transporte Caldo Tioglicolato.
Se evaluaron los siguientes parámetros clínicos: 1. Índice Gingival (Loe y Silenes, 1963)12; 2. Índice del bioflim (Silness y Löe 1964)13; 3. La profundidad de sondaje (PS); 4. El nivel de inserción clínica utilizando una sonda periodontal Goldman FOX con calibración Williams (Hu-Fridey)14, por un examinador previamente calibrado. De cada uno de los pacientes evaluados, se obtuvieron radiografías periapicales cono paralelo, para corroborar diagnóstico periodontal.
Las muestras fueron sembradas en placas de agar sangre y agar chocolate con vitamina K e incubadas en condiciones de anaerobiosis en jarra de Gaspak a 37°C durante 7 a 14 días. Las colonias características de bacterias anaerobias, pigmentadas o no, se subcultivaron en medios de agar sangre para su purificación y se incubaron bajo las mismas condiciones de anaerobiosis. La identificación de las bacterias se realizó mediante el uso de pruebas enzimáticas, estandarizadas y miniaturizadas del sistema de VITEK ®2 que miden la utilización de la fuente de carbono y actividad enzimática por parte de las bacterias. Se realizaron pruebas bioquímicas complementarias (indol, catalasa) para identificar otras colonias bacterianas.
Se emplearon métodos estadísticos descriptivos: media, desviación típica y porcentajes para medir los resultados de las diferentes variables del estudio. Además, se realizó un contraste de hipótesis mediante la prueba no paramétrica de Mann-Whitney, midiendo el grado de independencia de las diferentes variables. Para el procesamiento estadístico descriptivo e inferencial se empleó el Software Estadístico SPSS para Macintosh, Versión Nº 20.
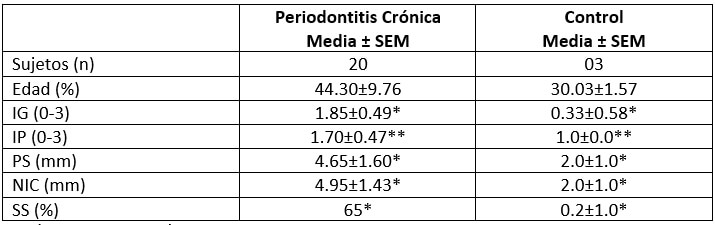
De los 20 pacientes seleccionados, 14 (70%) pertenecían al sexo femenino y 6 (30%) al masculino, con edades comprendida entre 29 y 72 años, siendo la edad promedio 44,30 ±09,76. Los valores de los parámetros clínicos obtenidos mostraron diferencias estadísticas significativas entre el grupo en estudio con periodontitis crónica, quienes presentaron promedios más elevados, en comparación al grupo control (Tabla I), los cuales confirmaron el diagnostico de periodontitis crónica. Luego de 7 días de incubación, se aislaron colonias bacterianas anaeróbicas estrictas de los pacientes 12/20, caracterizadas por ser de color marrón oscuro a negro, pequeñas, brillantes, convexas y de bordes regulares. A la coloración de Gram, se observaron bacilos Gram negativos pleomórficos, sugestivas de especies de Prevotella y Porphyromonas, así como también cocos Gram negativos posiblemente pertenecientes a especies de Veillonella. Se utilizó el sistema VITEK®2, para la identificación de las especies anaeróbicas, encontrándose mayor frecuencia para P. gingivalis (26%), P. intermedia (17%) y Veillonella spp (9%). Cuando se relacionó la profundidad de sondaje con las especies bacterianas Gram negativas obtenidas, se observó que la recuperación de estas bacterias fue principalmente en sacos periodontales entre 6-7 mm (83.34%) y en sitios con nivel de inserción entre 6-7 mm (50%).
La periodontitis es una enfermedad infecciosa que genera inflamación de los tejidos de soporte dental, pérdida de inserción progresiva y pérdida ósea, caracterizada por la formación de sacos que pueden afectar un número variable de dientes y que muestra diferentes velocidades de progresión 11.
Slots (1979), define la periodontitis como una enfermedad infecciosa relacionada con la acumulación de biopelícula y cálculo dental, siendo las bacterias anaerobias Gram negativas, los microorganismos principalmente involucrados15, incluso se considera que algunas bacterias de la microbiota subgingival son indicadores de riesgo para la progresión de las periodontitis16. Las diferentes especies bacterianas acumuladas sobre la estructura dental, pueden bien, proteger la colonización por patógenos exógenos o constituir el inicio, progresión y destrucción de las estructuras periodontales17. Está ampliamente aceptado que la periodontitis tiene un origen multifactorial, donde el componente microbiano modula el sistema inmune del hospedero susceptible, causando daño sobre los tejidos de soporte y protección del diente. Además de modular, existe un grupo de bacterias denominadas patógenos periodontales, que son patógenas a los tejidos mediante la expresión de diferentes factores de virulencia, en la cual destacan lipopolisacáridos, toxinas y proteasas extracelulares18.
En este estudio se detectaron dos bacterias periodonto patógenas, anaerobias estrictas Gram negativas, obtenidas a partir de colonias aisladas de muestras de sacos periodontales, siendo P. gingivalis (29.0%) la que se recupero con mayor frecuencia, seguida de P.intermedia (17.0%).
Estos resultados son similares a los reportados por Guilarte y col.19, quienes determinaron la presencia de especies de bacilos Gram Negativos en pacientes con periodontitis crónica. Las muestras de los sacos periodontales de los pacientes con periodontitis fueron tomadas con conos de papel y transportadas en el medio de Caldo Tioglicolato pre-reducido y luego sembradas en Agar Sangre Base Schaedler para el cultivo de anaerobios y la identificación se realizó a través de las pruebas enzimáticas RAPID ID 32A, reportando Prevotella intermedia (36,66%), Prevotella melaninogenica (6,66%), Prevotella loescheii (16,66%), Porphyromonas gingivalis (30,99%), Fusobacterium nucleatum (3,33%) y Bacteriodes spp. (3,33%), siendo las bacterias P. intermedia y P. gingivalis, las especies más frecuentes. Sin embargo, en nuestro estudio se pudo recuperar mas la especie P. gingivalis que P. intermedia con el Sistema VITEK®2. Otras investigaciones realizadas por Salari y Kadkhoda20, Botero y col.21, Timermman y col.22, Ardila y col.8, utilizando medios de cultivo tradicionales y pruebas bioquímicas convencionales y sistemas comerciales, coinciden al reportar que P. gingivalis es una de las especies bacterianas frecuentemente aislada y en mayor porcentaje en pacientes con periodontitis crónica.
También se identificó en este estudio Veillonella spp en un 9%. Estos resultados se asemejan al trabajo de Ximenez-Fyvie y col.23, quienes encontraron V. párvula en pacientes con periodontitis y con mayor prevalencia en salud periodontal en 5.94% y 6.80% respectivamente. La literatura consultada reporta la presencia de especies de Veillonella, tanto en pacientes con periodontitis como en estado de salud periodontal. Esta bacteria se considera como beneficiosa, y en la mayoría de los casos, se comporta como enlace con otras especies bacterianas periodontopatógenas más virulentas10,24. Newman y col.25, reporta en sus estudios la presencia de este microorganismo en proporciones bajas, en sitios con destrucción periodontal activa. Estos hechos indican que las especies de Veionella no son consideradas hasta el momento una bacteria periodontopatogena, sino una bacteria secundaria en esta enfermedad que potencia a otras especies mas virulentas.
Al relacionar la profundidad del saco periodontal, P. gingivalis y P. intermedia, se aislaron en pacientes con sacos de 6 a 7 mm, lo cual podría significar que estos microorganismos se pueden recuperar mejor de sacos profundos, donde existe un ambiente más propicio para el crecimiento de bacterias periodonto patógenas anaerobias estrictas21. Estos resultados coinciden con los de Guilarte y col.19, quienes reportaron, P. gingivalis en sacos profundos (5-10mm) y P. intermedia en sacos moderados, y, Nogueira y col.26, quienes mostraron que P. intermedia se recuperó de sacos periodontales entre 5-6 mm y P. gingivalis significativamente de sacos periodontales entre 7-10mm. P. gingivalis se pudo recuperar de sitios con nivel de inserción clínica de 6-7 mm, P. intermedia se observó en sitios con nivel de inserción en rangos de 4-5mm y 6-7mm, Veillonella spp., en sitios con nivel de inserción de 4-5mm. Almaguer y col.27, sostienen que el aislamiento de P. gingivalis tiende a ser más elevado en sitios con mayor evidencia de disminución de soporte (5-6mm y ≥ 6mm). Nuestros estudios también coinciden con los de Zambon28, quien sugirió que P. gingivalis está fuertemente asociado con resorción ósea, sacos profundos ﹥5 mm, perdida de adherencia y sangrado al sondaje. Sin embargo, Socransky y col.29, señalan que las bacterias periodontopatógenas pueden estar presentes en zonas sin que exista destrucción, pero si están en sitios enfermos se puede presentar mayor daño a futuro. Además, que los sitios infectados con estas bacterias específicas, pueden servir como reservorios para infectar otros sitios del mismo individuo. Así mismo, Mombelli y col.30, reportan que, los parámetros clínicos como profundidad de sondaje, nivel de inserción movilidad, sangramiento y supuración, son signos que se asocian a la presencia de patógenos periodontales, permiten el diagnóstico de la enfermedad, así como también, informan sobre la progresión y severidad de la misma.
Cabe señalar que las bacterias periodonto patógenas anaerobias Gram-negativas aisladas en este trabajo, predominaron en molares (35%), seguidos del sector anterior y premolar. Resultados que coinciden con lo de Mombelli y col.30, Persson y col.31 y, Wu Ya-min y col.32.
Microorganismos como, A. actinomycetemcomitans, no pudieron ser detectados en este estudio, posiblemente debido a que no se utilizó un medio más específico para su aislamiento y a que se encuentra más asociado a periodontitis agresiva, aunque existen reportes que señalan su aislamiento en pacientes con periodontitis crónica32,33.
Actualmente existen varias pruebas inmunológicas y de biología molecular, para el aislamiento e identificación de bacterias periodontopatógenas, metodologías empleadas por su alta sensibilidad y especificidad, sin embargo, en nuestro medio no son métodos de rutina para su detección, es por ello, la importancia de los diferentes medios de cultivo selectivos, que, aunque con menor sensibilidad y especificidad, son considerados en países en vías de desarrollo, el estándar por algunos investigadores y constituye la metodología en el estudio de estas patologías, pues permiten la detección de bacterias presentes en las muestras de los sacos periodontales y posteriormente la realización de pruebas de sensibilidad antibiótica. Por lo tanto, el aislamiento y detección de bacterias periodontopatógenas a través de los medios de cultivo, continúan siendo una herramienta útil en este tipo de estudio, siempre y cuando se consideren todas las condiciones que requiere el crecimiento de este tipo de bacterias, como lo reporta Donald y col.34.
Es de hacer notar que pocas bacterias periodontopatógenas, fueron recuperados en este trabajo, este hecho podría deberse a la pérdida de viabilidad durante la toma de la muestra, su transporte al laboratorio y posteriormente durante su cultivo. Ya es conocido que estas especies bacterianas son muy exigentes en cuanto a nutrientes, temperatura de incubación y presencia de oxígeno, entre otras condiciones necesarias para una recuperación exitosa.
En conclusión, bajo las condiciones en que se realizó el presente estudio, se logro la identificación de las bacterias periodontopatógenas, P. gingivalis y P. intermedia, por el sistema VITEK ®2, siendo P. gingivalis la más frecuente encontrada en los sacos periodontales mas profundos de los pacientes evaluados.