Recibido para arbitraje: 16/02/2018
Aprobado para su publicación: 15/08/2018
Desde hace dos décadas los implantes dentales se han tomado como opción inicial de tratamiento rehabilitador en los pacientes que requieren planificación protésica parcial o total, permitiendo anclajes firmes en el hueso que dan la posibilidad del uso de prótesis con excelente pronóstico a largo plazo. El tejido blando perimplantar es la zona de encía adyacente al área superior del implante conformada por epitelio y tejido conectivo, que permite el sellado del surco formado alrededor del mismo que, junto a la oseointegración, ofrecen cada vez mejores resultados estéticos y clínicos. La Hormona de Crecimiento es un péptido con 191 aminoácidos; fisiológicamente es secretada por la pituitaria anterior con diversas funciones mitogénicas y metabólicas. La Somatrotopina, como también es conocida, ha sido sintetizada desde hace años y diversos estudios soportan su efecto a nivel local planteándose la posibilidad de un mayor crecimiento del tejido blando perimplantar posterior a la cirugía con implantes dentales. Objetivo: Determinar los efectos histopatológicos de la Hormona de Crecimiento (HC) sobre la mucosa perimplantar de un grupo de individuos sanos. Metodología: Las intervenciones se realizaron en el Servicio de Cirugía Bucal de la Facultad de Odontología de la Universidad Central de Venezuela y el análisis histopatológico de las muestras se realizó en el laboratorio de la Unidad de Medicina y Patología Bucal y Maxilofacial en el Centro Integral Santa Rosa de Lima. Se estudió un total de 16 muestras obtenidas de 4 pacientes, por coincidencia todas de género femenino, referidas del Centro de Investigación y Diagnóstico Clínico FOUCV y del Postgrado de Prótesis de la FOUCV, las cuales necesitaban colocación de implantes dentales tardíos en zona mandibular bilateral. En el lado control se colocaron solamente los implantes y en el lado contralateral (experimental) se colocó Hormona de Crecimiento liofilizada en la zona apical del lecho y en la zona superior del implante antes de la síntesis de los tejidos. El Muestreo fue No Probabilístico de tipo intencional, donde la muestra estuvo representada por las mucosas tomadas adyacentes a los implantes dentales colocados según previo análisis de cada caso.Las variables fueron comparadas usando pruebas no paramétricas.Con un valor de significancia p<0.05 para que fuesen considerados estadísticamente significativos, para un nivel de confianza del 95%. Los datos registrados fueron expresados mediante cuadros y gráficos relacionados con las variables. Resultados. La Hormona de Crecimiento presentó cambios positivos en la cicatrización de la mucosa periimplantar en las variables tipo de queratina, número de vasos sanguíneos, grado de inflamación y como hallazgo presencia de tejido ósea. Conclusiones. Aunque entre las limitaciones del presente estudio se encuentren los resultados son en su mayoría estadísticamente no significativos por el tamaño de la muestra, se permite dejar este estudio como punto de partida para próximas investigaciones.
Palabras clave: Hormona de crecimiento, implantes dentales, mucosa periimplantar, estudio histopatológico.
For two decades dental implants have been taken as an initial option of rehabilitation treatment in patients who require partial or total prosthetic planning, allowing firm anchorages in the bone that give the possibility of the use of prostheses with excellent long-term prognosis. Perimplant soft tissue is the area of gingiva adjacent to the upper area of the implant formed by epithelium and connective tissue, which allows the sealing of the groove formed around it, which, together with osseointegration, offer increasingly better aesthetic and clinical results.The Growth Hormone is a peptide with 191 amino acids; Physiologically it is secreted by the anterior pituitary with diverse mitogenic and metabolic functions.Somatrotopin, as it is also known, has been synthesized for years and various studies support its effect at the local level considering the possibility of a greater growth of soft tissue perimplant after surgery with dental implants.Objective: To determine the histopathological effects of the Growth Hormone (HC) on the perimplant mucosa of a group of healthy individuals.Methodology: The interventions were performed in the Oral Surgery Service of the School of Dentistry of the Central University of Venezuela and the histopathological analysis of the samples was performed in the laboratory of the Oral and Maxillofacial Medicine and Pathology Unit at the Santa Integral Center Rosa de Lima. We studied a total of 16 samples obtained from 4 patients, by coincidence all of female gender, referred from the FOUCV Clinical Research and Diagnostic Center and the Prosthesis Postgraduate of the FOUCV, which needed late dental implant placement in the bilateral mandibular area.On the control side, only the implants were placed and on the contralateral (experimental) side lyophilized Growth Hormone was placed in the apical area of the bed and in the upper area of the implant before the synthesis of the tissues.The sampling was non-probabilistic of intentional type, where the sample was represented by the mucous membranes taken adjacent to the dental implants placed according to previous analysis of each case. The variables were compared using nonparametric tests.With a value of significance p <0.05 to be considered statistically significant, for a confidence level of 95%. The recorded data were expressed by tables and graphs related to the variables.Results The Growth Hormone presented positive changes in the peri-implant mucosal healing in the variables type of keratin, number of blood vessels, degree of inflammation and as a finding presence of bone tissue. Conclusions Although among the limitations of this study are the results are mostly statistically not significant by the size of the sample, it is allowed to leave this study as a starting point for future research.
Key words: Growth hormone, dental implants, peri-implant mucosa, histopathological study
Autor de correspondencia: Ortíz María de Jesús.Profesora Instructora, Facultad de Odontología, Universidad Central de Venezuela. Ciudad Universitaria, Los Chaguaramos. Caracas 1060. [email protected]
Los implantes dentales han logrado escalar gran parte de las alternativas ofrecidas a los pacientes como parte del tratamiento rehabilitador en espacios edéntulos parciales o totales, donde la mayoría de los casos requiere una evaluación exhaustiva y el éxito del tratamiento se basa en la interacción con otras disciplinas enalteciendo el enfoque multidisciplinario, consiguiendo un mutuo entendimiento, cooperación y coordinación para llevar a cabo el diagnóstico, plan de tratamiento y mantenimiento que permitan ofrecer resultados clínicos por largo plazo1-7. Una base elemental de la implantología es incrementar la unión íntima y funcional que se presenta entre los tejidos duros y tejidos blandos al implante, lo cual incluye la osteointegración y la formación de un sulcus o surco periimplantario, la inserción epitelial, el contacto del tejido conectivo con la superficie del implante, es decir, enalteciendo la importancia del sellado biológico periimplatario en conjunto a la integración ósea6-10.
La Hormona de Crecimiento, también llamada Somatotropina, es una hormona peptídica estimulada por la adenohipófisis de gran importancia en el cuerpo humano, y entre sus funciones estan el crecimiento, la reproducción celular y la regeneración; la tecnología ADN recombinante ha creado la hormona Somatropina (Genotropin ®)11 sintetizada y utilizada en gran espacio del área médica y actualmente en el área de odontología, siendo los primeros estudios en la línea de Cirugía Bucal, Maxilofacial e Implantes Dentales1-4,5,9. Ésta puede ser aplicada de forma local en el hueso justo antes del implante y en la zona supracrestal previo al cierre de la mucosa10.
Se pretende mediante esta investigación, estudiar y determinar si la hormona de crecimiento produce cambios tisulares en la mucosa adyacente al implante dental, potenciando la calidad del tejido periimplantar y disminuyendo el tiempo de cicatrización a través de mecanismos que controlan localmente el reclutamiento, la migración, la proliferación y la diferenciación celular en el lecho receptor, estableciendo así un sistema de amplificación autocrina local7,9,10,17,19., observando de manera cualitativa y cuantitativa mediante técnicas de histopatología, para comparar entre el lado experimental y el lado control si el número de vasos sanguíneos neo formados presentes varía en su número, e incluso como posible hallazgo histopatológico, la presencia en algunas muestras de material óseo obtenido de las mismas, siendo estas variables observadas de forma cualitativa y cuantitativa mediante estudios histopatológicos. De igual forma, se podrá determinar no solo los beneficios del uso de la Hormona de Crecimiento11-19, sino también si existen efectos secundarios en su uso10,18,19.
Siendo éste el primer estudio con esta metodología y esta variable a valorar, es de gran importancia el aporte que permitirá saber el efecto tisular en la mucosa de la Hormona de Crecimiento, ayudando en el proceso de estabilidad del implante al proporcionar mejor sellado del tejido perimplantar que contribuya a mayor barrera mecánica para el paso de microorganismos, protegiendo la oseointegración, mejorando el grosor del epitelio que beneficie la fase protésica e incluso mejorando el perfil de emergencia que además creará condiciones estéticas más favorables10,17,18
Los procedimientos quirúrgicos del presente estudio se llevaron a cabo en el servicio del Postgrado de Cirugía Bucal de la Facultad de Odontología de la Universidad Central de Venezuela.
La población se basó en la totalidad de los pacientes que asistieron al servicio del Postgrado de Cirugía Bucal de la Facultad de Odontología de la Universidad Central de Venezuela, durante el período Marzo 2014 y Mayo 2015, que tenían la necesidad de colocarse implantes dentales de forma tardía, que hubiesen leído y firmado el Consentimiento Informado avalado por el Comité de Bioética de la Facultad de Odontología de la UCV. Los Criterios de Inclusión para la selección fueron: pacientes con necesidad de implantes dentales adicionándoles HC.; pacientes que se les planifique colocaciones tardías de implantes dentales de dos fases quirúrgicas; pacientes que se encuentren edéntulos parciales bilaterales de varios espacios en mandíbula; Pacientes mayores de dieciocho años; pacientes con una línea mucogingival de más de 3 o 4 mm en la zona de colocación de los implantes dentales y con encía adherida superior a 2mm. Los criterios de exclusión comprenden: pacientes fumadores; pacientes que presenten hábitos parafuncionales; pacientes con enfermedades sistémicas; pacientes con enfermedad periodontal no tratada; pacientes con zonas a tratar con lesiones de origen infeccioso, tumores o irradiados; pacientes que tengan áreas óseas tratados previamente por Regeneración Ósea; pacientes embarazadas; pacientes con terapia de Bifosfonatos; pacientes menores de dieciocho años; pacientes con necesidad de algún tipo de injerto óseo o de tejido blando; pacientes que estén tomando medicamentos crónicos, antibióticos o antiinflamatorios, que no puedan ser suspendidos mínimo con tres meses de antelación a la colocación de los implantes dentales; pacientes sin disposición para el estudio.
El Muestreo fue No Probabilístico de tipo intencional, donde la muestra estuvo representada por las mucosas tomadas adyacentes a los implantes dentales colocados según previo análisis de cada caso. Las 16 muestras fueron tomadas de un total de 4 pacientes, todas del género femenino (sin ser criterio de inclusión el género), las cuales agruparon lo correspondiente a 16 implantes dentales, teniéndose: una paciente con planificación de 6 implantes, dos pacientes con planificación de 4 implantes y una paciente con planificación de 2 implantes.
Se realizó una historia integral médica para obtener la información necesaria del estado de salud del paciente, permitiendo evaluar si al realizar la anamnesis general, existe algún riesgo asociado a la colocación de los implantes, incluyendo antecedentes sistémicos, si toma algún medicamento, alergias presentes o referidas con anterioridad, toma de la presión arterial o hábitos como el tabáquico que imposibilitarían al paciente a participar en el estudio. Se les realizaron fotografías extrabucales e intrabucales, valoración de imagenología con tomografía ConeBeam y planificación protésica de cada caso.
Para el acto quirúrgico se realizó el método simple de aleatorización mediante el Lanzamiento de Moneda, para determinar el lado correspondiente al Grupo Control y al Grupo Experimental con la adición de Hormona de Crecimiento, resultando el lado derecho como el lado de la intervención (experimental). No hubo ningún tipo de selección que afectase la edad o el género del paciente; se solicitó a cada paciente la higiene bucal completa para que no hubiese presencia de irritantes locales que complicaran la limpieza del área cercana al lugar receptor. Se consideró la disponibilidad de una cava por el autor para el traslado de la Hormona de Crecimiento, ya que la misma exige cadena de frío para la condición de sus propiedades.
Durante el fresado se colocó la velocidad entre 1200 a 1500 RPM (revoluciones por minuto) considerando que en la zona de escogencia para este estudio el hueso es tipo II, normalmente corticado, se utilizó la fresa inicial tipo lanza o redonda de 1.8 mm y 2 mm de diámetro, posteriormente se siguió el protocolo de aumentar el tamaño del diámetro en forma paulatina con fresas de poco sección de corte para evitar el sobrecalentamiento del tejido óseo y quitando el empaquetamiento que evita el poder de corte. Se limpió la fresa que sale del hueso y se retiró el hueso autólogo recolectado, se limpió con solución fisiológica.
La técnica de incisión con hoja de bisturí nº 15, realizando descargas mesial y distal paramarginal a los dientes vecinos, recta sobre el reborde con desplazamiento hacia lingual de 2 mm aproximadamente, para realizar el levantamiento del colgajo de espesor total o mucoperióstico. A todos los pacientes se les colocó implantes dentales de la casa comercial MIS® modelo Seven® roscados con hexágono interno, de titanio con arenado y tratamiento de grabado ácido en su superficie, de las longitudes comprendidas entre 8 a 11.5 mm y de diámetros desde 3.3 a 4.20 mm.
Luego fue colocada la HC en la zona adyacente a la cabeza del implante, entre el colgajo y el lecho quirúrgico, se utilizó Hormona de Crecimiento recombinante humana liofilizada (Genotripin ®) 5.3 mg/ 16 UI utilizando la totalidad equivalente para cada área supraimplantar (previo a la síntesis de los tejidos), donde la presentación de la Hormona es en polvo liofilizado (somatotropina). Se reposiciona el colgajo de forma deslizante afrontando los bordes de la herida sin ninguna señal de tensión y se hace la síntesis de los tejidos en puntos simples con sutura Seda Negra 3-0.
Para la antibióticoterapia se recetó Amoxicilina en cápsulas de 500 mg cada 8 horas por 7 días ó en caso de pacientes alérgicos a la Penincilina: Clindamicina en Cápsulas de 300 mg cada 6 horas por 7 días. Para la analgesia se indicó Ibuprofeno en tabletas de 600mg, 1 cada 6 horas por 3 días y luego sólo en caso de dolor. El esquema de controles postoperatorios se llevó a cabo a las primeras veinticuatro (24) horas, luego a las setenta y dos (72) horas, después semanal y luego una vez al mes por tres meses. Se indicó a los pacientes traer para el primer control semanal una Radiografía Panorámica y periapicales del área implantada, para realizar evaluación respectiva y retiro de puntos.
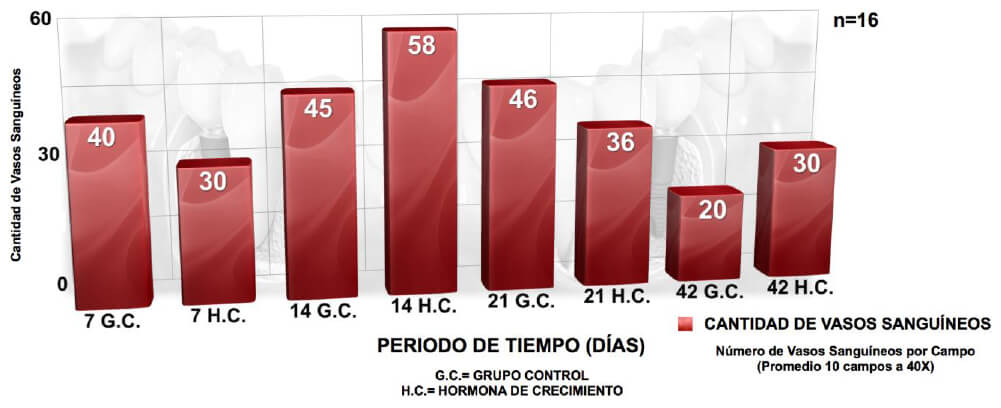
Para la toma de las muestras de estudio, se decidió realizar los destapes en diferentes intérvalos de tiempo para que, basados en los objetivos que se persigue en la presente investigación, determinar los cambios en las variables en diferentes momentos: cantidad de vasos sanguíneos formados y alguna evidencia de célula ósea.
Las muestras fueron tomadas considerando que bioéticamente solo se puede realizar una (1) toma de destape por implante, por lo que los pacientes (dependiendo del número de implantes colocados) fueron seleccionadas de forma aleatorizada para los diferentes momentos de destape: 7 días, 14 días, 21 días ó 42 días. En cada cita de destape, a los pacientes se les tomó la muestra del lado control (izquierdo) y del lado experimental (derecho) en ubicación simétrica, es decir, por pares de implantes. Esta muestra de tejido blando periimplantar, se llevó a cabo realizando los siguientes pasos: Localización radiográfica de los implantes dentales para orientación de la ubicación externa de los mismos; se llevó a cabo barrido mecánico del área a anestesiar. Se realizó bloqueo a distancia de la zona (para que no se altera la muestra), con Lidocaína 2% Epinefrina 1:100.000 de los nervios involucrados del área de forma infiltrativa y se confirma la efectividad del área anestesiada. Se estableció el diámetro de la mucosa marcando el área de la muestra con el dispositivo en el cual viene presentado el implante dental MIS® modelo Seven® ubicado en el tubo plástico interno, el cual es metálico, de forma esférica y presenta un diámetro promedio de 4 mm. Luego con una hoja de bisturí Parker Nº 15 se hizo la incisión en la mucosa periimplantar para tomar el tapón gingival, tanto del lado control como del lado experimental (HC).
Inmediatamente se colocó el tornillo de cicatrización de tejidos blandos o de segunda fase acordado para cada caso. Se explica a los pacientes las indicaciones postoperatorias verbalmente y se entregan por escrito, teniéndose que todos los pasos realizados durante los diferentes procedimientos quirúrgicos fueron debidamente registrados en la hoja de evolución de la Historia Clínica de cada paciente para mejor control.
Las muestras se enviaron para el estudio histopatológico en base al código previamente establecido. La identificación de la muestra no fue entregada a los patólogos ni al técnico. En total se enviaron 16 muestras correspondientes a 8 del lado control (sin la hormona de crecimiento) y a 8 del lado experimental (con el agregado de la Hormona de Crecimiento). A todos los pacientes se les realizó controles seguidos continuos para verificar ausencia de complicaciones y luego quedaron en tratamiento con el servicio del Postgrado de Prótesis de la misma institución.
Todos los pasos realizados durante los diferentes procedimientos quirúrgicos fueron debidamente registrados en la hoja de evolución de la Historia Clínica de cada paciente para mejor control.
Las muestras tomadas de la mucosa periimplantar fueron conservadas en solución amortiguadora con formol diluido al 10% y enviadas a estudio histopatológico, donde fueron evaluadas independientemente y de forma separada por dos patólogos altamente calificados en el área. A cada uno de ellos se le entregó unas tablas con una nomenclatura, sin especificación del origen de las muestras, para el registro de la impresión diagnóstica de cada una. El estudio histopatológico se realizó bajo doble enmascaramiento como confina la presente investigación, siendo así analizadas las 16 muestras. Una vez obtenidos los resultados de los patológicos, éstos fueron trasladados a una matriz de recolección de datos donde fueron registrados según la codificación asignada a cada paciente y cada muestra tomada.
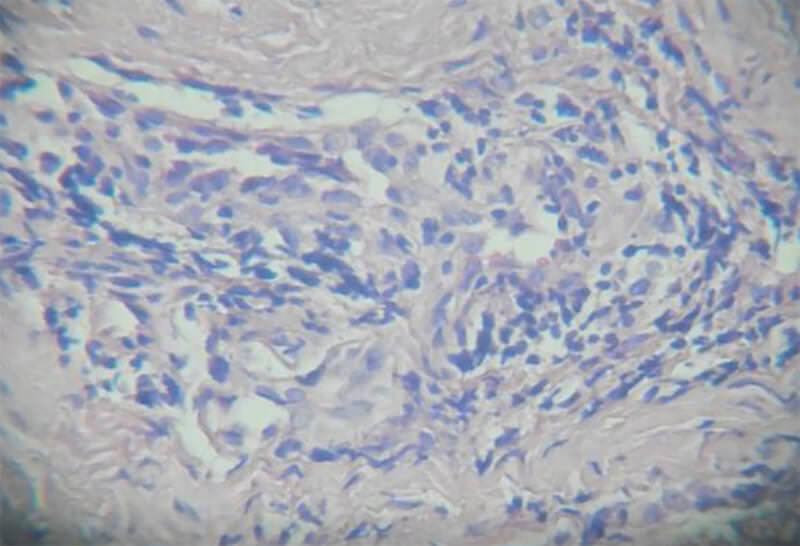
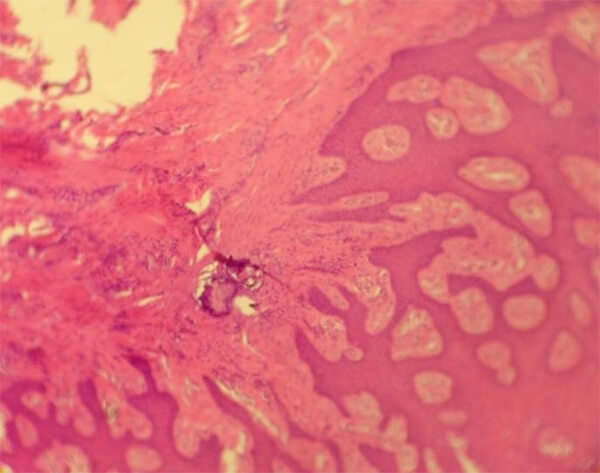
Posterior al estudio histopatológico, se seleccionaron las láminas más representativas para el registro fotográfico y fueron observadas en el microscopio de doble visión, marca Olimpus USA.
Los datos recolectados en la presente investigación han sido tomados y desarrollados en las tablas previamente aprobadas por la estadístico del estudio, donde se verificó la confiabilidad que brindaban según las características de las variables, teniendo alta precaución de que los datos fuesen lo más sincero y fidedignos posible.
El presente estudio está basado en la repetición de un marco metodológico existente10 pero con otra intervención (Hormona de Crecimiento), permitiendo así continuar los parámetros de confiabilidad que brinda el marco científico y estadístico, por lo que los factores externos se mantienen exactos como el ambiente de quirófano, la operadora, la asistente, la casa comercial de implantes, la técnica quirúrgica, el protocolo para la colocación del implante y de la Hormona, la técnica para la toma de la muestra (biopsia) del tejido periimplantar, el medio de conservación y envío de las mismas al estudio histopatológico. En base a esto se le brinda a los resultados un alto nivel de confiabilidad.
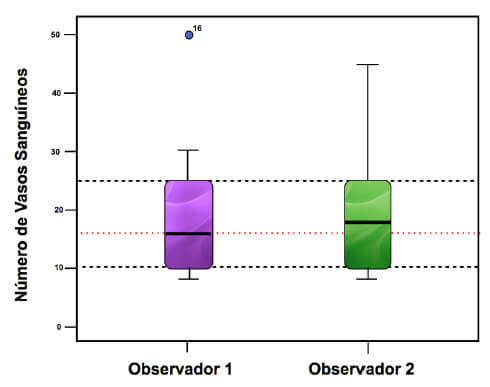
Considerando que la presente investigación se encuentra dentro del marco metodológico del tipo Casos y Controles, los resultados fueron orientados en la relación entre persona, factor y tiempo transcurrido. Los datos obtenidos en el presente estudio se recolectaron directamente de la realidad como fuente inicial, por lo tanto son considerados datos de tipo primarios u originales. El nivel de confiabilidad del estudio, viene soportado por tres variantes: los observadores, entre los instrumentos y en los resultados. En el presente estudio se tomaron los datos de resultados y se confirmó la veracidad de los mismos con respecto a los dos observadores dentro del marco del doble enmascaramiento con que se dio más valor a los mismos.
Todos los datos recolectados fueron introducidos en la base de datos del paquete estadístico SPSS® (StatisticalPackageforthe Social Sciences) versión 17.0. Con la finalidad de cumplir con los objetivos del estudio y dar respuesta a la(s) pregunta(s) de investigación se decidió realizar los siguientes análisis de los datos obtenidos con el instrumento utilizado: confiabilidad de los resultados obtenidos en el instrumento utilizando para la interpretación de los observadores por medio del alfa de Cronbach; Un análisis entre e intra observadores a partir del modelo ANOVA por medio del Índice Kappa de Cohen; Un análisis correlacional entre las variables tiempo y factor y lo obtenido por los observadores.
Las variables fueron comparadas usando pruebas no paramétricas. Con un valor de significancia p<0.05 para que fuesen considerados estadísticamente significativos, para un nivel de confianza del 95%. Los datos registrados fueron expresados mediante gráficos relacionados con las variables.
El carácter o nivel exploratorio del presente estudio, obedeció a que el tema objeto de investigación ha sido poco o nada abordado, permitiendo el desarrollo de este trabajo y un acercamiento a dicha realidad, estableciéndose las posibles relaciones entre las variables, constituyéndose así en un punto de partida importante para realizar investigaciones de mayor profundidad. Lamentablemente no existen estudios de investigación previos, parecidos o relacionados que traten directamente sobre la aplicación de la HC en la mucosa periimplantar y que evalúen los cambios en las muestras obtenidas con técnicas de histología; lo que complica la discusión de los resultados debido a que no se tienen puntos exactos de comparación.
En un estudio realizado por el Dr. Sosa10 La Fibrina Rica en Plaquetas (FRP) se ha constituido como uno de los compuestos autólogos con mayor aplicabilidad en el campo de la Cirugía Bucal y Maxilofacial8,10, perteneciendo a la segunda generación de concentrados plaquetarios9; teniendo la gran ventaja de no contar, entre sus efectos, con ningún tipo de reacciones adversas a diferencia de sus predecesores9,10. Se ha demostrado que la Hormona de Crecimiento es capaz de regular los procesos de la inflamación y estimular el proceso inmunológico de la quimiotaxis8,15,17. En diversos estudios realizados, esta matriz natural parece acelerar la curación fisiológica de las heridas por lo que durante los últimos años, la Hormona de Crecimiento se han usado ampliamente como un suplemento en los procedimientos de regeneración de tejidos blandos8,10-22. Afianzándose cada vez más su uso como aliado y potenciador en el proceso de curación y regeneración de las heridas en los tejidos de la mucosa bucal.10
Con respecto a la cantidad de Vasos Sanguíneos presentes, podemos destacar que con la aplicación de FRP y con el transcurrir del tiempo se evidenció que el número de vasos sanguíneos disminuía, obteniéndose una correlación estadísticamente significativa en este análisis10; esto se puede explicar porque aunque una de las propiedades de la HC es regenerador celular, es lo que esta formación de vasos sanguíneos se evidencia en mayor medida a la primera semana, llegando a contarse hasta veinte (20) vasos sanguíneos por campo en las muestras tratadas con HC y luego con el transcurrir del tiempo la cantidad de vasos sanguíneos en las muestras correspondientes disminuyen llegando hasta un número de 10 vasos sanguíneos en la sexta semana, y al inicio del proceso de curación al comienzo el tejido existente es principalmente de granulación compuesto por gran cantidad de vasos sanguíneos y pocas fibras colágenas, con el transcurrir del tiempo el tejido pasa a ser fibroso con menos contenido de vasos sanguíneos y mucho mayor cantidad de fibras colágenas. En el estudio realizado por Sosa, no presentó resultados estadísticamente significativos con respecto a la cantidad de vasos sanguíneos con respecto a la aplicación del factor (PRP) y en relación al tiempo transcurrido10
En la investigación de Sosa10 se evidenció presencia de células de formación ósea en varias de las muestras estudiadas, donde la variable usada (PRP) dio pauta de crecimiento en el tejido periimplantar. En la presente investigación, la neoformación ósea fue solamente observada en dos de los casos con HC, a pesar que ésta no fue estadísticamente significativa (p=0.055), queda como estudio piloto para futuros trabajos con un número mayor de muestras.