Recibido para arbitraje: 18/05/2007
Aceptado para publicación: 27/06/2007
RESUMEN |
INTRODUCCION
El Liquen Plano es una inflamación crónica de la epidermis y de la mucosa que a menudo dura toda la vida y se alterna con periodos de exacerbación y remisión. Como toda enfermedad inmunológica, involucra en su fisiopatología, procesos relacionados con las células efectoras del sistema inmune. En la piel, se presenta como pápulas aplanadas, violáceas, pruriginosas, que confluyen focalmente dando lugar a placas que pueden tener puntos o líneas blanquecinas denominadas estrías de Wickhan. En la cavidad bucal se presenta como lesiones blancas, rojas o mixtas. (1, 2, 3) Las lesiones pueden afectar la superficie cutánea y oral en un 40% de los casos, exclusivamente la superficie cutánea, o tan solo la mucosa.
En cavidad bucal el sitio predilecto para la aparición de las lesiones es la mucosa bucal, seguido por la encía/reborde alveolar y la lengua. (4)
En la actualidad no se ha identificado el agente etiológico específico del Liquen Plano.
Sin embargo algunos autores han sugerido (5) que el inicio y el mantenimiento de las lesiones requieren la presencia de células T específicas para un antígeno.(6) Se ha investigado mucho acerca de la identidad de este antígeno. Especial interés suscita la siguiente pregunta: ¿se trata de un antígeno exógeno o endógeno? Al respecto, se ha detectado un antígeno específico, mediante inmunofluorescencia indirecta, en lesiones de pacientes con Liquen Plano cutáneo, a nivel de la capa de células espinosas y granular. Al mismo se le ha denominado "Antígeno liquen plano-específico"( 7) Sin embargo, en estudios de Liquen Plano Bucal, la inmunofluorescencia directa de tejido de lesiones no permite demostrar la presencia de ese antígeno. Aunque, en un tercio de los casos, el suero de los pacientes reacciona positivamente contra el tejido alogénico lesional de pacientes con Liquen Plano cutáneo que presentan dicho antígeno (8).
Los intentos fallidos de varios investigadores en encontrar al "Antígeno Liquen Plano-específico" en las lesiones de Liquen Plano Bucal puede deberse a varias causas: filtración del antígeno en la saliva, bajos niveles del antígeno en el epitelio bucal o simplemente el Liquen Plano Bucal no constituye la misma entidad que el Liquen Plano cutáneo, idea no apoyada por la mayoría de los autores. (8)
En los últimos años se le ha dado importancia al papel que cumplen ciertos superantígenos (9) ; también se destaca la predisposición genética a padecer Liquen Plano y la presencia de moléculas del Complejo de Histocompatibilidad (HLA) se ha reportado (10, 11), sin embargo, no se ha encontrado una frecuencia significativa de antígenos alterados en los pacientes con Liquen Plano Bucal.
Se ha relacionado la expresión de las proteínas de Shock térmico y las citoqueratinas (Cks) con la patogénesis de la enfermedad, (12) encontrando una relación estadísticamente significativa entre la expresión de estas proteínas a nivel de las capas basales del epitelio y la presencia de la lesión por Liquen Plano. Se ha sugerido que éstas proteínas actúan como autoantígenos en el Lupus eritematoso y en la artritis reumatoidea Algunos autores proponen una hipótesis en la cual, un individuo genéticamente predispuesto puede desarrollar una reacción inmune mediada por células con infiltración subepitelial de linfocitos T originada por un hapteno, un antígeno convencional o un superantígeno que proceda de la microflora bucal. (12, 13)
La generación de citocinas por parte de estas células, puede sobre-expresar proteínas de Shock térmico como la HSP60 en los queratinocitos basales adyacentes. Lo que sucede después depende si el individuo está genéticamente predispuesto a reaccionar inmunológicamente en contra de la HSP60. Si no lo está, la primera reacción inmune será una mucositis no específica. Si tiene la predisposición genética debido a que posee ciertos complejos mayores de histocompatibilidad (HLA-Bw57 ó HLA-DR2); entonces la reacción continuará con el desarrollo de linfocitos T citotóxicos que atacan a los queratinocitos basales causando una destrucción autoinmune (una de las características del Liquen Plano bucal).
La reacción comienza con la activación de las células de Langerhans la cual presenta un antígeno a los linfocitos CD4+. Estas células promueven la destrucción epitelial a través de las moléculas de adhesión ICAM-1 y LFA-1, posteriormente la producción de citocinas, y la expresión de ICAM-1 y VCAM-1 pueden activar a los CD8+, dándole el carácter crónico a esta lesión 14. El predominio de mastocitos durante la fase de formación de la lesión de Liquen, sugiere que ellas también juegan un papel activo, a través de la acción de sus mediadores químicos sobre las células endoteliales. Estos mediadores, que se liberan rápidamente después de la desgranulación, incluyen; aminas vasoactivas, enzimas que inducen la vasodilatación e incrementan la permeabilidad vascular y Factor de Necrosis Tumoral-derivado de mastocitos (TNF-?), el cual induce, entre otras cosas, la expresión en las células endoteliales de ICAM-1 y E-selectina (CD62E), moléculas necesarias para la permanencia y activación de los CD8+ que son responsables directos del daño epitelial (15).
Algunos autores consideran al Liquen Plano como una enfermedad multifactorial donde hay que considerar el factor psicológico (es considerada por muchos como una enfermedad psicosomática). Un alto porcentaje de pacientes reportan que han experimentado sucesos de vida estresantes en el inicio de la enfermedad.
Adicionalmente, índices elevados de ansiedad han sido encontrados en los estudios de investigación de estos pacientes, considerándose como un factor precipitante o desencadenante de la lesión (16, 17).
Sin embargo este punto todavía es motivo de controversia: se ha determinado que los pacientes sometidos a eventos cargados de stress aumentan sus concentraciones de cortisol en saliva (18). Los individuos sometidos a situaciones experimentales de stress responden con hipersecreción de cortisol (19). Si el stress no es seguido de un incremento en los niveles séricos de cortisol, la respuesta del sistema inmune puede no ser adecuadamente suprimida y pueden desarrollarse reacciones adversas de tipo autoinmune (20)
También se ha relacionado a varios agentes infecciosos, tales como virus herpes simple 1, virus herpes simple 6, citomegalovirus, virus papiloma humano, virus Epstein-Barr y Helicobacter pylori con el Liquen Plano Bucal (21, 22).
MATERIALES Y MÉTODOS
En el presente estudio se incluyeron dos grupos de individuos. El primero de ellos estuvo constituido por 20 pacientes con Liquen plano Bucal. El diagnóstico clínico se corroboró mediante estudio histopatológico (muestra de biopsia de las lesiones fijada en formol, incluida en parafina) y teñida con hematoxilina-eosina) e inmunofluorescencia directa positiva para fibrinógeno.
Todos los pacientes fueron atendidos en el Servicio de Clínica Estomatológica "Magdalena Mata de Hening" de la Facultad de Odontología de la Universidad Central de Venezuela y en el Instituto de Biomedicina del Hospital José María Vargas de Caracas entre los años 2002-2003. Se excluyeron del grupo; aquellos pacientes con lesiones liquenoides en vecindad con restauraciones metálicas y/o de acrílico que hubiesen aparecido posterior a la colocación de las mismas, pacientes con medicaciones sistémicas antihipertensivas, antidiabéticas y antidepresivas previas a la aparición de las lesiones, pacientes con enfermedades inmunológicas como lupus eritematoso, eritema multiforme, enfermedad de rechazo de injerto y SIDA, y pacientes con displasias y/o carcinoma in situ (23).
El segundo grupo estuvo conformado por 10 individuos con mucosas bucales sanas y sin antecedentes de Liquen Plano Bucal (Grupo Control). Los pacientes de este grupo fueron atendidos en el post-grado de cirugía bucal y en el quirófano de Periodoncia de 2003, para realizarle tratamientos como exodoncias a colgajo de los terceros molares y alargamiento de corona clínica. Las muestras tomadas eran de mucosa sana.
Todos los pacientes firmaron el consentimiento informado para participar en la investigación, siguiendo las directrices de la declaración de Helsinki (23).
En todos los casos se completó un protocolo de estudio donde se recogieron datos personales del paciente, enfermedad actual, hábitos, antecedentes médicos, localización y características clínicas de las lesiones, características histopatológicas e inmunofluorescencia directa, análisis sanguíneo, Los análisis histopatológicos y de inmunofluorescencia fueron realizados siempre por dos histopatólogos en el Instituto Anatomopatológico "José A. O'Daly" en la Facultad de Medicina de la Universidad Central de Venezuela.
Manejo tisular. El material biológico consistió en muestras de tejido bucal obtenido mediante biopsias incisionales bajo anestesia local (lidocaína al 2% con epinefrina 1: 100.000 A.T.O. Zizine. París Francia), que se practicaban en los pacientes del servicio para diagnosticar lesiones con impresión diagnóstica de Liquen Plano Bucal (siguiendo los criterios de exclusión del grupo 1). Las muestras de tejido provenientes de lesiones ulcerosas o erosivas eran obtenidas mediante incisión proveniente de zonas cercanas al sitio ulcerado, con el objeto de obtener un tejido con epitelio sano que permitiera observar la inmunoreacción a nivel de la unión epitelio-corión. En las lesiones reticulares las muestras se obtenían de las zonas blanquecinas.
Dichas muestras de tejido se dividían en varias porciones; una para ser fijada en formol tamponado, embebida en parafina, seccionada en microtomo (5 µm), y teñida con hematoxilina-eosina para su análisis histopatológico. Otra que se colocaba en solución fisiológica (muestra en fresco que incluía tejido no ulcerado) para la realización de la inmunofluorescencia directa con anticuerpos policlonales fluoresceinados anti C1q, fibrinógeno, C3, IgM, C4, IgG, IgA. (Dako Corporation, Conpenhagen, Denmark)-Los tejidos previamente cortados eran fijados en acetona por 10 min, seguido de tres lavados por 10 min con buffer fosfato salino (PBS), pH 7,2. Las nuestras eran incubadas por 60 min con los anticuerpos previamente mencionados diluidos 1:20. Posteriormente se procedía a lavar nuevamente con PBS y se examinaban al microscopio para inmunofluorescencia.
Análisis estadístico
El análisis estadístico entre los resultados de ambos grupos se realizó mediante la utilización de la prueba de Fisher (Fisher Exact Test) procesando los datos mediante el software SPSS® para Windows versión 9.0 (©1998 SPSS Inc. Derechos reservados).
RESULTADOS
El estudio se realizó en un grupo de pacientes provenientes de los Servicios de Medicina Estomatológica de la Facultad de Odontología de la Universidad Central de Venezuela y de Dermatología en el Instituto de Biomedicina. En este estudio fue evaluada una población total de 30 individuos, de los cuales 20 presentaban lesiones de Liquen Plano Bucal y 10 constituyeron el grupo control. El promedio de edad del grupo de los pacientes con Liquen Plano Bucal, fue de 50,85 ± 14.8 (X ± DS), con un rango de edad entre 28 y 75 años. Para el grupo control el promedio de edad fue de 38,6 ± 19.43 (X ± DS) con un rango de edad entre 21 y 85 años.
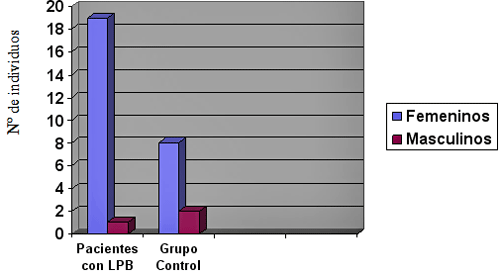
Con respecto a la distribución de los pacientes con Liquen Plano Bucal y grupo control según el género, se observó un predominio del género femenino en el grupo de pacientes con lesiones de Liquen Plano Bucal con 19/20 pacientes (95%), y solo un paciente del género masculino (5%). En el grupo control 8/10 pacientes fueron del género femenino (80%) y 2/10 de género masculino (20%) (Gráfico 1)
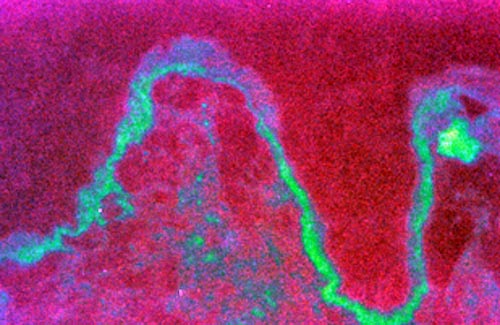
Referente a la evaluación de la localización de Fibrinógeno en las muestras de los pacientes con Liquen Plano Bucal por inmunofluorescencia, todas las muestras fueron positivas para fibrinógeno en los pacientes con Liquen Plano Bucal. En la figura N°1 se puede observar el inmunomarcaje a todo lo largo de la unión corión-epitelial.
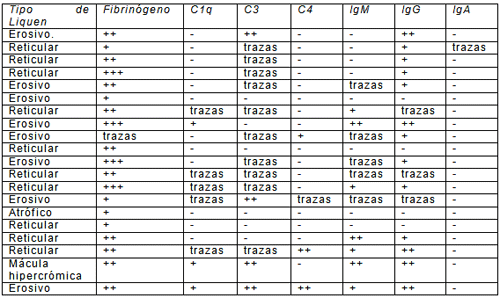
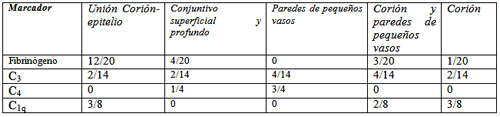
La Evaluación de las moléculas del complemento C3, C4, C1q y de los anticuerpos IgM, IgG e IgA por inmunofluorescencia directa en relación al tipo de Liquen Plano Bucal, demostraron que al evaluar la presencia de inmunoglobulinas 16/20 (80%) de las muestras resultaron positivas para IgG, siendo el tipo reticular el que presentó mayor número de inmunoreactividad (50%) para este anticuerpo. En relación a las moléculas de complemento 14/20 muestras (70%) resultaron positivas para las proteínas del complemento C3, y 8/20 (37.5%), para la presencia de C1q, siendo el tipo reticular el que presentó mayor número de muestras positivas para ambos marcadores. Mientras que 4/20 (20%) muestras resultaron positivas para C4, siendo el tipo erosivo el que presentó mayor número de muestras inmunopositivas (75%).
En relación a la presencia de anticuerpos de la clase IgM e IgA; 12/20 muestras (60%) resultaron positivas para IgM, siendo más frecuente en el tipo reticular (41.6%). Solamente 1/20 muestras (5%) resultó positiva para IgA, y ésta se presento en una muestra de tipo reticular (Tabla 1).
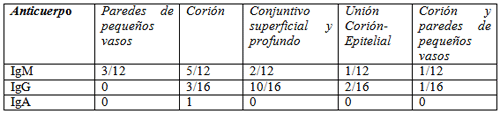
Localización de la inmunopositividad para el fibrinógeno, los anticuerpos IgG, IgM e IgA y las moléculas del complemento C3, C4 y C1q: La localización más frecuente para el fibrinógeno fue la unión corión-epitelial con 12/20 muestra positivas (60%), mientras que para la IgM se observó más frecuentemente a nivel del corión, con 5/12 muestras (42%). En relación a la IgG la inmunopositividad se presentó en el tejido conjuntivo tanto superficial como profundo (submucosa) con 10/16 muestras positivas (63%). La IgA solo se presentó en el corión de un solo caso.
Con respecto a las proteínas del complemento, para el C1q la localización más frecuente fue el corión y la unión corión-epitelio con 3/8 (38%) muestras positivas; mientras que para C3 fue las paredes de los pequeños vasos con 4/14 muestras positivas (29%). Para el C4 la localización más frecuente fue las paredes de los pequeños vasos con 3/4 muestras positivas (75%) (Tablas 2 y 3).
DISCUSIÓN
La etiología del Liquen Plano Bucal ha sido controversial y los diferentes estudios reportados en la literatura científica, lejos de clarificar definitivamente los aspectos más polémicos, generalmente abren la puerta para aumentar la discusión. En el presente estudio la distribución de pacientes con Liquen Plano Bucal según edad y género coincide con otros autores (24, 25), los cuales han reportado que las mujeres entre la cuarta y quinta década de la vida representan el grupo más afectado por esta enfermedad. En efecto, el promedio de edad de 57 años del grupo de pacientes evaluados se aproxima al reportado por otros autores (4). Cabe destacar la marcada predilección del género femenino observada en esta investigación, donde el 95% de los pacientes fueron mujeres.
Referente a la evaluación de las biopsias por inmunofluorescencia directa; todas las muestras del grupo con Liquen Plano fueron positivas en el inmunomarcaje para fibrinógeno, la mayoría a lo largo de la unión corión-epitelial y algunas incluso más profundamente en el corión, hasta las paredes de los pequeños vasos. Esta positividad para el fibrinógeno ha sido reportada con mucha frecuencia (26-31). En la actualidad la molécula del fibrinógeno se considera una de las características distintivas del Liquen Plano Bucal, e incluso una prueba diagnóstica (28).
Un hallazgo importante de esta investigación fue que un gran número de pacientes del grupo con Liquen (80%) resultaron también positivos en la inmunofluorescencia directa para la presencia de anticuerpos IgG. Es interesante comparar estos resultados con los de otros autores (32) quienes no encontraron esta inmunoglobulina en ninguno de los casos con Liquen Plano Bucal evaluados. Así mismo, se ha reportado (33) que no se observó una asociación entre la IgG circulante y el Liquen Plano Bucal. Sin embargo, se ha reportado IgG circulante anti-epitelial en pacientes con Liquen (35), mientras que otros autores han encontrado depósitos lineares de IgG en la zona basal del epitelio en las lesiones cutáneas de Liquen Penfigoide. (36)
En nuestra investigación aparece con una frecuencia bien importante que llama la atención sobre todo por su ubicación a nivel del tejido conjuntivo superficial y profundo en un 63% de las muestras positivas para IgG, e incluso con localización submucosa en el resto de las muestras.
Al analizar estos datos, se puede sugerir la utilización de manera más frecuente de la prueba de inmunofuorescencia directa para IgG, sobre todo en aquellos casos dudosos en donde el inmunomarcaje para fibrinógeno no sea tan intenso. Ya se evidenció en nuestros resultados que dicho marcador fue un acompañante frecuente del fibrinógeno a todo lo largo del corión en la gran mayoría de las muestras con Liquen Plano evaluadas.
Algunas investigaciones refieren (37) niveles de IgG antiepitelial en saliva conjuntamente con la IgA en pacientes con Liquen Plano Bucal y con otras enfermedades bucales de carácter autoinmune. Más recientemente (38) se encontró mediante pruebas ELISA una sobre-expresión de IL-6; una citocina que estimula la secreción de IgG y la diferenciación de células B, también en pacientes con la enfermedad.
Resultados como estos conllevan a plantearse la hipótesis acerca del papel de los mediadores químicos y los plasmocitos en la fisiopatología del Liquen Plano Bucal. ¿Es principalmente una reacción citotóxica mediada por CD8+ la etiopatogenia del Liquen Plano Bucal? ¿Cuál es el verdadero papel de los linfocitos B? ¿Cómo actúan anticuerpos como IgG en el inicio y mantenimiento de las lesiones? Estas preguntas podrán ser contestadas en futuras investigaciones que basadas en estos resultados indaguen un poco más acerca del papel de los anticuerpos en la etiología y el mantenimiento de las lesiones de Liquen Plano Bucal.
Una condición similar se observa cuando se revisa la inmunoreacción para la inmunoglobulina IgM. En el presente estudio 12 de las 20 (60%) muestras de Liquen Plano Bucal fueron inmunopositivas para este anticuerpo, principalmente a lo largo del corión. Estos resultados difieren de otros trabajos (38,38) donde no se apreció en ninguna de las muestras de Liquen Plano Bucal analizadas mediante inmunohistoquímica y mediante inmunofluorescencia directa, expresión del anticuerpo en las biopsias.
Al respecto Ostman y col (38) se plantean la incógnita acerca de la naturaleza de la respuesta inmunológica en los pacientes con Liquen Plano Bucal; sugiriendo que, la respuesta humoral se presenta como consecuencia de varios estímulos que ocurren e interactúan simultáneamente como por ejemplo; el producido por la presencia de ciertos materiales dentales, infecciones, la ingesta de medicamentos y otros.
Al evaluar el anticuerpo IgA, una muestra de Liquen Plano reticular presentó inmunoreacción para IgA a lo largo del corión. Mientras que Sistig y col 36 encontraron valores aumentados de este anticuerpo en la saliva de los pacientes con Liquen Plano Bucal. Sin embargo, (38) no encontraron marcaje para IgA en la zona de la membrana basal del epitelio de sus muestras con Liquen Plano mediante inmunohistoquímica. Resultados similares son observados por otros investigadores (32,-38) Este hallazgo no concordante para esta enfermedad, permitirá seguir especulando acerca del verdadero papel que juega la respuesta humoral en la etiopatogenia del Liquen. De hecho; todos los anticuerpos evaluados se presentaron con mayor frecuencia en el tipo reticular de Liquen Plano; esto destaca la necesidad de que se realicen investigaciones que permitan establecer una asociación entre una forma clínica en particular de Liquen Plano y la presencia de los mismos.
Al evaluar algunos parámetros involucrados en la respuesta innata se presentaron 14 muestras positivas para la molécula del complemento C3, principalmente localizado en paredes de pequeños vasos, en el grupo de Liquen Plano. A esto se suma el hecho de que 3 muestras resultaron positivas para C1q y 3 para C4 a nivel del corión y en las paredes de pequeños vasos. La validez del complemento como prueba diagnóstica no está del todo clara. En la presente investigación un gran número de muestras resultaron positivas para C3, lo que pudiera representar una orientación diagnóstica, sin embargo, existen pocos reportes en la literatura que apoyen estos hallazgos.
Se reportaron en otra investigación depósitos lineares de C3 a todo lo largo de la unión corión-epitelio en muestras de Liquen Plano Penfigoide, (39, 40) pero, en nuestra investigación, la mayoría de los casos positivos para complemento fueron Liquen Plano reticular, una entidad totalmente distinta desde el punto de vista clínico.
Incluso, en otros reportes se ha asociado el Liquen plano con una disminución en los niveles séricos de C4 (41), aunque otros autores contradicen esos reportes (42).
Fayyazzi y col (43) se plantean la hipótesis de un papel protagónico del complemento en la patogénesis del Liquen Plano cutáneo, mientras que otros reportes no encontaron moléculas del complemento en ninguna de sus 26 muestras de Liquen Plano Bucal analizados mediante inmunofluerescencia directa. (32)
Como se puede apreciar, la literatura científica al respecto es contradictoria. En la actualidad no se conoce cuál es el verdadero significado de la presencia de las moléculas del complemento en esta patología, constituyéndose en un tema interesante para abordar en futuras investigaciones. A partir de nuestros resultados se podría inferir que la inmunoexpresión de complemento puede deberse a la presencia de un antígeno exógeno que desencadenaría la respuesta inmunológica en las lesiones de Liquen. Quizá esa respuesta de inmunidad innata se desencadena ante la presencia de un agente infeccioso como el Virus Epstein Barr y es precisamente el complemento, el "enlace" entre una activación leucocítica primaria y la cronicidad típica que representa un infiltrado linfocítico continuo a lo largo de toda la unión corión-epitelio. Mediante esta investigación no se puede comprobar lo antes expuesto, pero representa un hallazgo interesante para seguir investigando acerca de la importancia del complemento en la fisiopatología del Liquen.
BIBLIOGRAFÍA
|