Trabajos Originales
Fibroblasto: célula fundamental en la salud y en la enfermedad periodontal
Recibido para Arbitraje: 02/06/2014
Aceptado para publicación: 25/06/2014Ucero, C. T., Profesor Asociado de la Facultad de Odontología de la Universidad de Carabobo. Valencia-Venezuela. Acosta, Y., Profesor Asociado de la Facultad de Odontología de la Universidad de Carabobo. Valencia-Venezuela. Montero, M., Profesor Agregado de la Facultad de Odontología de la Universidad de Carabobo. Valencia-Venezuela.
CORRESPONDENCIA: Carmen T., Ucero B. [email protected]
FIBROBLASTO: CÉLULA FUNDAMENTAL EN LA SALUD Y EN LA ENFERMEDAD PERIODONTAL
RESUMEN
Las células mesenquimáticas son precursoras de un variado grupo de células del tejido conjuntivo, que incluyen a las células endoteliales, células del músculo liso, pericitos, condroblastos, adipocitos, osteoblastos, odontoblastos y fibroblastos. Los fibroblastos son una población heterogénea de células que se encuentran en numerosos tejidos. Además, es el tipo de célula predominante del estroma en los tejidos conjuntivos blandos. Estas células y sus productos de la matriz extracelular, es decir, fibras y sustancia fundamental amorfa desempeñan papeles fundamentales en el mantenimiento de la integridad estructural de los tejidos conjuntivos. Aun cuando los fibroblastos son fenotípicamente estables, presentan subpoblaciones heterogéneas, que regulan la forma y la función del tejido. La distribución en los tejidos y la proporción relativa de estas subpoblaciones de fibroblastos tienen un impacto considerable en la regulación de la función del tejido conjuntivo en la salud y la enfermedad.
El propósito de esta revisión fue actualizar el conocimiento acerca de los fibroblastos proporcionando información con respecto a la heterogeneidad y versatibilidad de estas células, reconociendo su participación en la inmunidad, la regeneración y la remodelación de tejidos, así como, su más reciente significación como célula madre pluripotente inducida.
PALABRAS CLAVE: fibroblastos, fibroblastos periodontales, regeneración periodontal, periodontitis, receptores Toll-like, célula madre pluripotente inducida
FIBROBLAST: ESSENTIAL CELL IN HEALTH AND PERIODONTAL DISEASE
ABSTRACT
Mesenchymal cells are precursors to a diverse group of connective tissue cells, including endothelial cells, smooth muscle cells, pericytes, chondroblasts, adipocytes, osteoblasts, odontoblasts, and fibroblasts. Fibroblasts are a heterogeneous population of cells that are found in many tissues. Moreover, is the predominant type of stromal cell in soft connective tissues. These cells and their extracellular matrix products, fibers and amorphous ground substance play key roles in maintaining the structural integrity of connective tissues. Even when the fibroblasts are phenotypically stable, have subpopulations heterogeneous regulating the shape and function of the tissue. The tissue distribution and the relative proportion of these subpopulations of fibroblasts have a considerable impact on the regulation of connective tissue function in health and disease.
The purpose of this review was to update the knowledge of fibroblasts by providing information regarding the heterogeneity and versatility of these cells, recognizing their involvement in immunity, regeneration and tissue remodeling, as well as its newest significance as a cell induced pluripotent stem.
KEYWORDS: Fibroblasts, periodontal fibroblasts, periodontal regeneration, periodontitis, Toll-like receptors, induced pluripotent stem cell. |
Durante décadas, la periodoncia se ha enfocado en resolver las secuelas de la enfermedad periodontal. Dando origen a variados tratamientos, con el objetivo de regenerar el aparato de inserción de la estructura dentaria afectada, no obstante, en este afán la resultante que se ha obtenido la mayoría de las veces ha sido la reparación del mismo. En este sentido, lograr la reconstrucción periodontal exitosa, exige no solo la regeneración del ligamento periodontal (LPD), sino también del cemento, hueso alveolar y encía. Para ello se requiere de la estabilidad de un proceso biológico complejo, donde interaccionan células, factores locales y sistémicos, así como, componentes propios de la Matriz ExtraCelular (MEC).
Simultáneamente, por generaciones, se ha tratado la MEC en el proceso destructivo del periodonto. Diversos modelos se han propuesto buscando dilucidar la evolución de la patología periodontal, confluyendo en el enfoque inmunológico en correspondencia con la respuesta de cada individuo.
Es por ello que, recientemente la vista y el interés se han reubicado en el fibroblasto componente principal del tejido conjuntivo que conforma el LPD en el ser humano. Los fibroblastos se caracterizan por ser células dinámicas, no homogéneas entre sí, dado que, presentan variaciones morfológicas y funcionales de acuerdo a su localización.
A partir de esta apreciación, el presente artículo de revisión se propone dar a conocer al fibroblasto como protagonista y elemento fundamental en salud y enfermedad periodontal, proporcionando información con respecto a la heterogeneidad y versatibilidad de estas células, reconociendo su participación en la inmunidad, la regeneración y la remodelación de tejidos, así como, su más reciente significación como célula madre pluripotente inducida.
INMUNIDADEl LPD, contiene predominantemente fibroblastos que conectan el cemento de la raíz del diente al hueso alveolar circundante, y representa una población multipotente de distintos linajes de fibroblastos con una variedad de funciones, tales como: defensa del huésped como resultado de la expresión constitutiva de marcadores típicos en la superficie de células presentadoras de antígenos y por interactuar con células de inmunidad innata, tales como, células dendríticas y macrófagos
1. En las enfermedades infecciosas bacterianas, el sistema inmune innato reconoce Patrones Moleculares Asociados a Patógenos (PMAPs) a través de una variedad de receptores de reconocimiento (RRs), y este reconocimiento se traduce en el desarrollo de reacciones inflamatoria. Los RRs, tales como, receptores toll-like (TLR), son esenciales para la respuesta inmune en los mamíferos, ya que, estos funcionan como sensores innatos de los componentes de la pared celular de bacterias. Los PMAPs bacterianos representativos son los lipopolisacárido (LPS) de las bacterias Gram-negativas y los peptidoglicanos (PGN) de cualquier bacteria Gram-positiva o Gram negativo, que son reconocidos por TLR4 y TLR2, respectivamente
2.
La infección bacteriana crónica de las estructuras que soportan los dientes causa la destrucción del tejido conjuntivo periodontal, del hueso y en casos severos pérdida del diente. El inicio y la progresión de la enfermedad inflamatoria periodontal, resulta de la respuesta del huésped a bacterias de la placa, tales como,
Porphyromonas gingivalis,
Actinobacillus aggregatibacter y
Prevotella intermedia a través de los TLR, Receptores Activados por Proteasas (RAPs) y receptores de dominio de oligomerización de unión a nucleótidos (NOD). Recientemente, se encontró que las células del LPD estimuladas con bacterias Gram-negativas periodontales y sus LPS mostraron aumento de la expresión de TLR2, TLR4 y citocinas pro-inflamatorios y anti-inflamatoria
3. Estas células, están involucradas en los mecanismos de inflamación crónica al expresar una variedad de citocinas que regula la respuesta inmune dependiente de células T. Además, las células LPD estimuladas con citocinas proinflamatorias, tales como IL-1b, IL-17A e interferón gamma (IFN-?) podría facilitar el reclutamiento de leucocitos. Junto con las células inmunes, los TLR que se expresan en el tejido periodontal, en respuesta a la invasión microbiana desencadenan respuesta inmune inflamatoria innata, que es importante para la eliminación de patógenos
4.
Se ha reportado
4 que, los Fibroblastos del Ligamento Periodontal Humano (FLPDH) expresan constitutivamente TLR2 y TLR4. Así como, la expresión de TLR y NOD en fibroblastos gingivales y pulpares
5. Además, está demostrado el aumento de la secreción de InterLeucina IL-1b, IL-6, e IL-8 por los FLPD en respuesta no sólo a ligandos TLR, sino también a los ligandos NOD. Estos hallazgos sugieren que TLR2, TLR4, NOD1, y NOD2 en los FLPD juegan papeles importantes en la respuesta inflamatoria del tejido periodontal, que conduce a la periodontitis progresiva
5.
Los fibroblastos del LPD, interaccionan con bacterias en el tejido periodontal y producen varias citocinas pro-inflamatorias, tales como IL-1b, IL-6, e IL-8 en el sitio de inflamación
1,2,3. Estas citocinas pro-inflamatorias se han observado en las lesiones periodontales y son presumiblemente importantes en el desarrollo de la periodontitis. La IL-1b es la forma predominante que se encuentra en las lesiones periapicales humanas y sus exudados. La IL-6 es una de las principales mediadoras de la respuesta del huésped a las lesiones y las infecciones, esta podría activar a los osteoclastos y finalmente causar la reabsorción. La IL-8 podría inducir a la infiltración de neutrófilos en el tejido periodontal, que es un rasgo característico de la fase inicial de la periodontitis
4.
Los fibroblastos del LPD (FLPDs), son responsables también de la producción y la degradación de la mayoría de los componentes de la MEC. Por lo tanto, los FLPDs juegan un papel principal en el mantenimiento y la rotación fisiológica del LPD y en los procesos de degradación patológicos de la MEC en la periodontitis. Los FLPD secretan diversos mediadores solubles de la inflamación en estimulación con citocinas o agentes patógenos bacterianos, que contribuyen a la degradación del LPD
6,7.
La producción excesiva de metaloproteinasas de la matriz (MMPs) conduce a la acelerada degradación de la matriz, que está asociada con condiciones patológicas tales como periodontitis y periodontitis apical. Las colagenasas (MMP-1, MMP-8, y MMP-13) y gelatinasas (MMP-2 y MMP-9) son las MMPs principales que participan en la digestión de colágeno en el LPD y el hueso6.
Se conoce que, el inductor de las metaloproteinasas de la MEC (EMMPRIN), originalmente señalado como CD147, es una glicoproteína transmembrana que es capaz de inducir la producción de MMPs por los fibroblastos8. Varios estudios han señalado el vínculo entre EMMPRIN y la periodontitis
6,7,9. De allí que, los altos niveles del péptido EMMPRIN y el ARNm se han asociado con la progresión de la enfermedad periodontal, así, la expresión de EMMPRIN dependiente de la inflamación se correlaciona con la pérdida de hueso alveolar y la degradación del colágeno7.
También, se ha identificado la presencia de IL-17R en los FLPD, lo que indica que la IL-17 se une a IL-17R en FLPD. La IL-17 es un mediador crítico en la inflamación y la defensa del huésped contra organismos bacterianos. Los modelos propuestos sugieren que los productos de las bacterias durante la infección inducen directamente a un subconjunto de las células T a secretar IL-17. La IL-17 actúa sobre el microambiente del tejido infectado y órganos hematopoyéticos para liberar mediadores secundarios, incluyendo las quimiocinas, los péptidos antimicrobianos, los de remodelación del tejido y los de respuesta de fase aguda, que a su vez, reactivan el proceso inflamatorio
10.
Estudios
9,11 han implicado a la IL-17 en la patogénesis de la enfermedades periodontales debido a sus efectos sobre la producción de ligando del receptor activador del factor nuclear kappa B (RANKL) en la función de los polimorfonucleares neutrófilos y activación de los osteoclastos. En este sentido, Wu y cols.,
12 demostraron que la IL-17 fue capaz de aumentar la expresión de genes y la producción de varias MMPs en los FLPD, que contribuyen a la degradación del tejido en áreas peridontales.
Además, mostró los efectos de la IL-17 sobre la expresión de las MMPs, del inhibidor tisular de las metaloproteinasa (TIMP) y EMMPRIN en los FLPD. La IL-17 eleva tanto los genes, como la expresión de la proteína de MMP-1 y MMP-13, pero disminuye a la MMP-2, MMP-9 y TIMP-1. En contraste, la IL-17 no tiene ningún efecto sobre los niveles de ARNm y de la proteína de EMMPRIN. Estos resultados sugieren que la IL-17 facilita la destrucción en el tejido periodontal en parte por la regulación diferencial de la expresión MMP y TIMP de los FLPD residentes durante la inflamación periodontal
12.
Las MMPs son capaces de degradar casi todos los componentes de la MEC. Entre estos componentes, la actividad de la colagenasa es crítica para el colágeno fibrilar, que representa el componente principal del periodonto y el hueso alveolar6.
Los FLPD responden a la IL-17 con aumento en la producción de proteínas de MMP-1 y MMP-13, ya que, los neutrófilos polimorfonucleares son la fuente principal de MMP-89. En este sentido, Andonovska y cols., demostró que los procesos crónicos periodontales y/o periapicales de grandes dimensiones tienen altas concentraciones de MMP-1, MMP-8, y MMP-13
13.
En este contexto, llama la atención estudios recientes
14,15 que muestran que, la inducción de la inflamación aumenta el catabolismo del triptófano, lo que podría inhibir la respuesta inflamatoria de las células T sugiriendo que la inflamación crónica puede ser asociada con una reducción en la biodisponibilidad de triptófano en medio ambiente bucal. La Indolamina 2,3-DiOxigenasa (IDO) es una enzima que cataboliza el triptófano, un aminoácido esencial para los mamíferos, que junto a la vía de la quinurenina muestra efectos inmuno-inhibitorios y efectos citotóxicos a través de un aumento de los metabolitos de triptófano, tales como 3-hidroxiquinurenina, ácido quinolínico y ácido 3-hidroxiantranílico. La disminución del Triptófano y producción de quinurenina por IDO induce la supresión de la respuesta de las células T y la tolerancia por conducir a la diferenciación de células T hacia células T reguladoras
14,15.
La IDO se expresa en una variedad de tipos de células, incluyendo monocitos, macrófagos, células dendríticas, fibroblastos, células epiteliales y varias líneas de células cancerígenas por la acción de varios agentes inflamatorios y citocinas inmunomoduladoras. Los fibroblastos gingivales (FG) y dérmicos al producir IDO juegan un papel importante como potente inhibidor de la activación, proliferación y supervivencia de los linfocitos T en los tejidos
15.
Los primeros estudios mostraron que, el IFN-
y es un potente inductor de la producción de IDO, que está implicado en la defensa del huésped contra muchos patógenos intracelulares, incluidos Toxoplasma, Mycobacterium y el virus del herpes simple. Factor de necrosis tumoral-alfa (TNF-
a), IL-1 y LPS también inducen la producción de IDO solo o en combinación con IFN-
y16. Altos niveles de IFN-
y, IL-1 y TNF-
a fueron detectados en los tejidos de encías con periodontitis crónica, y los LPS de
Porphyromonas gingivalis e IFN-
y, solos o en combinación, inducen la producción de IDO en FG humanos
17.
Además, esta reportada la función inmunosupresora de las células LPD que expresaban IDO por LPS. Por lo tanto, la expresión de IDO inducida por LPS en el LPD puede ser uno de los varios mecanismos involucrados en la desregulación del proceso inflamatorio, el cual puede ser beneficioso en la prevención de la inflamación excesiva y la destrucción del tejido periodontal
16. Ya que, aunque las citocinas son necesarias para la reacción de defensa del huésped, la prolongación excesiva de la reacción inflamatoria podría resultar en la destrucción del tejido periodontal.
Por otra parte, se ha demostrado que las células T desempeñan un papel importante en la patogénesis de la periodontitis
9. Los fibroblastos podrían ofrecer una función inmunosupresora por el aumento de la expresión de CD274, al disminuir la activación y la proliferación de células T, después del tratamiento con citocinas inflamatorias
18. Teniendo en cuenta que la expresión de CD274 se ha asociado a la supresión del sistema inmune durante eventos particulares, tales como el embarazo, aloinjertos de tejidos, enfermedad autoinmune y otros estados de enfermedad, tales como la hepatitis
18.
REGENERACIÓNLa regeneración es la sustitución de tejido lesionado por un tejido morfológicamente y funcionalmente similar al alterado. El objetivo final de la terapia periodontal es controlar infección periodontal y regenerar el periodonto perdido, así como, brindar apoyo a los tejidos a su forma y a su función original. Este proceso requiere la formación de un nuevo LPD, nuevo cemento y hueso con fibras del LPD insertadas
19. Varios
20,21 enfoques terapéuticos para regeneración periodontal se han defendido en la literatura, incluyendo el uso de injertos óseos o sustitutos óseos, acondicionamiento de la superficie de la raíz, la regeneración tisular guiada (GTR), factores de crecimiento o enfoques combinados.
Los resultados clínicos después de la utilización de biomateriales para el tratamiento de defectos periodontales han demostrado aumento de los niveles de inserción y radiográficamente relleno óseo en comparación con el desbridamiento con colgajo abierto solo. Sin embargo, las diferentes tasas de éxito observadas a lo largo de los estudios demuestran que una regeneración completa y predecible de los tejidos periodontales sigue siendo difícil de obtener
21,22.
A nivel celular, el proceso de la regeneración de los tejidos periodontales requiere de la migración selectiva (quimiotaxis), la proliferación y la diferenciación de las células del LPD. Para estos fines, es de gran importancia una superficie radicular biocompatible adecuada para la repoblación celular. La superficie contaminada de la raíz involucrada periodontalmente con la microbiota periodontal y/o sus endotoxinas parece ser desfavorable para la recolonización con células responsables de la regeneración periodontal. Por lo tanto, se ha demostrado que el cemento enfermo inhibe la unión de células del tejido conjuntivo y la proliferación
23.
En este contexto, la formación y el mantenimiento de una unión estable entre la fibrina del coágulo sanguíneo y la superficie radicular es crucial para la óptima curación periodontal. Sin embargo, se ha demostrado que, tras el desbridamiento mecánico los agentes contaminantes residuales pueden poner en peligro la curación del tejido periodontal
23,24. Por lo tanto, varias modalidades de tratamiento, incluyendo el acondicionamiento de la raíz, la irradiación con láser y la aplicación de factores de crecimiento han sido utilizadas para proporcionar una superficie radicular más biocompatible para la temprana migración celular, la unión y el desarrollo de las fibras
24.
En este sentido, el acondicionamiento químico de la raíz con agentes desmineralizantes, tales como el ácido cítrico, tetraciclina y ácido etilendiaminotetraacético (EDTA) han sido ampliamente utilizado como una modalidad terapéutica para modificar la superficie de la raíz enferma. Sin embargo, a pesar de que varios estudios in vitro sugieren beneficio del acondicionamiento de la superficie radicular
24, ha sido demostrado que el acondicionamiento de la superficie de la raíz en los seres humanos no proporciona ninguna ventaja clínica
25. Más recientemente, el acondicionamiento de la superficie radicular se ha venido utilizando como un tratamiento previo antes de la aplicación de agentes regenerativos, como por ejemplo, el derivado de matriz de esmalte (MDE)
25.
De allí que, estudios
26,27, han señalado que el efecto en el periodonto de diferentes agentes terapéuticos administrados directamente en la superficie radicular está determinada por la biocompatibilidad de estos con los fibroblastos del LPD y han demostrado la capacidad del ácido etilendiaminotetraacético (EDTA) al 24% para mejorar la migración, la unión y la proliferación de los fibroblastos sobre superficies de la raíces enfermas.
También, se ha reportado
28 desde un punto de vista morfológico, que las células se muestran más adherente a la superficie radicular y se caracterizan por procesos citoplasmáticos con largas extensiones, apoyando que la desmineralización con el EDTA parece promover la colonización celular temprana y formación posterior de tejido al proporcionar una superficie radicular más biocompatible a la adhesión celular
28.
En contraste, las raíces enfermas tratadas con raspados radiculares fueron pobladas por pocas células con procesos citoplasmáticos limitados
28,29. Kasaj y cols., presentan evidencia de que el tratamiento con EDTA 24%, MDE y suspensión aceitosa de hidróxido de calcio (OCHS) mejora la superficie de la raíz para la pronta colonización de la célula periodontal cuando se compara con superficies radiculares enfermas con raspado radicular solamente. Aun cuando ellos hacen la salvedad de que, los resultados obtenidos por sus experimentos en el modelo in vitro no pueden recrear los eventos involucrados en la regeneración periodontal y la compleja interacción de las células in vivo
29.
REMODELACIÓNLas fuerzas aplicadas a los dientes se transmiten al LPD, constituido por células y componentes extracelulares localizadas entre el diente, el cemento y el hueso alveolar. Los tipos de células predominantes son los fibroblastos, células epiteliales y las células mesenquimatosas indiferenciadas. Los márgenes del LPD se componen de cementoblastos, osteoblastos, y osteoclastos
30.
En ortodoncia, las fuerzas mecánicas son necesarias para provocar movimiento dentario producto de cambios en el tejido periodontal. Las fuerzas inducen tensión mecánica en el microambiente de la MEC permitiendo cambios en las propias células. Estas fuerzas inducen a su vez cambios en la expresión de genes que pueden causar alteraciones en la viabilidad celular, la proliferación, y la diferenciación
30,31.
La formación de hueso nuevo en el sitio de la tensión del diente tradicionalmente se ha atribuido a los osteoblastos procedentes del hueso alveolar. Sin embargo, las células del LPD ha sido demostrado exhiben varios rasgos osteoblásticos, lo que sugiere que estas células tienen el potencial de diferenciarse en osteoblastos
32,33.
La MEC del LPD consiste principalmente de moléculas fibras y de sustancia fundamental. Los colágenos de tipo I y tipo III (COL-I y COL-III) producida por los osteoblastos y los fibroblastos son las principales moléculas de fibras. La síntesis de colágeno es un evento esencial en la proceso de remodelación del hueso alveolar inducida por medios mecánicos y el COL-I se conoce como sobreregulador de la formación de fibras de colágeno durante diferenciación osteoblástica
33.
Debido a que, la tensión mecánica desencadena una respuesta periodontal, parece probable que la tensión mecánica puede modular la respuesta del LPD en función del tipo, frecuencia, y la fuerza de tensión mecánica. De hecho, se informó que diversas magnitudes conducen a diferentes cambios en la expresión génica en las células del LPD. Estas células se ha informado son heterogéneas, y no está claro si la expresión de genes de todas las subpoblaciones de células del LPD actúan de la misma manera
34.
En este sentido, llama la atención como el movimiento dental ortodóncico rige la remodelación por los cambios en las células del LPD, incluyendo proliferación, diferenciación osteogénica y el recambio de proteoglicanos, que junto con el COL-1 pertenece a los principales constituyentes de la MEC
33.
Al analizar el efecto de la tensión mecánica sobre los fibroblastos se encontró que, la aplicación de 10% tensión cíclica sobre fibroblastos gingivales no eleva la tasa de apoptosis de estos, lo que indica que estas células son bastante resistentes a la tensión mecánica
35.
Jacobs
36 y cols., al estudiar la influencia de la tensión mecánica en la expresión de los marcadores de proliferación ciclina D1 encontraron aumento en la expresión de la ciclina D1 en HLPDF, pero la expresión de la ciclina D1 en osteoblastos (HOB) disminuyó con tensión mecánica estática (SMS) de 10% indicando una represión de la proliferación de células en el hueso alveolar bajo fuerte tensión mecánica.
En cuanto a la MEC, esta no sólo funciona como un tejido de resistencia mecánica para las células, sino que también proporciona la nutrición y la respuesta inmune. Desempeña un papel importante en el crecimiento, diferenciación y el metabolismo de células
37. Se ha encontrado discrepancias entre los resultados reportados en relación a la expresión génica de COL-I según la tensión sobre HLPDF y HOB, lo cual podría deberse a la constitución heterogénea de células del LPD, cuyos subtipos reaccionan de manera diferente, sin embargo HOB son las responsables de la producción COL-I en el sitio de la tensión del movimiento de los dientes durante la tratamiento de ortodoncia
36,37.
La SMS induce significativamente la actividad de fosfatasa alcalina (ALP) en HLPDF y HOB, mostrando que ambos tipos de células participan activamente en la restauración de tejido mineralizado bajo tensión mecánica
36-38.
El sistema OPG/RANKL es un indicador de la remodelación ósea y juega un papel importante en el movimiento ortodóncico39. Se ha observado aumento de la expresión génica y síntesis de OPG bajo tensión mecánica, con muy baja expresión de RANKL en HLPDF y HOB, que resulta en una relación alta OPG/RANKL, lo cual, es un requisito para la formación de hueso. Los FLPD muestran síntesis de proteína OPG sólo bajo ciertas condiciones, tales como, SMS de por lo menos 5%, esto aclara que es necesaria una tensión adecuada para estimular la diferenciación osteogénica de los FLPD
36. Al mismo tiempo, HOB ha mostrado una disminución en la síntesis de OPG bajo alta tensión mecánica, lo que demuestra el potencial supresor en la formación de hueso alveolar debido a la tensión de gran magnitud
36.
Por otra parte, está sustentado que la alta tensión es pro-inflamatoria y mejora la síntesis de IL-1b, que a su vez inhibe la actividad de la ALP. Esto también podría ser la razón para la reducción de la síntesis de OPG por HOB al 10% de SMS, porque se sabe que las citocinas inflamatorias pueden inhibir la síntesis de OPG
40.
PLURIPOTENCIALas Células Madres Embrionarias (CME) son células no diferenciadas que se caracterizan por ser autoproliferativas (capacidad de renovarse a sí mismas), así como, pluripotentes (capacidad de diferenciarse en varios tipos de células, múltiples tejidos y órganos)
41, es decir, estas células son capaces de diferenciarse en todos los derivados de las tres capas germinales primarias: ectodermo, endodermo y mesodermo.
Estas propiedades han llevado a las expectativas de que las CME humanas pueden ser útiles para comprender mecanismos de la enfermedad, reemplazar tejidos dañados, evaluar la efectividad y seguridad de medicamentos, siendo utilizadas para diferentes propósitos, incluyendo la terapia celular, la reparación de tejidos, la regeneración de órganos, y así sucesivamente
42. Por este motivo, grupos de investigación han estado estudiando estas células por su potencial terapéutico. Sin embargo, los estudios y aplicaciones CME humanas se ven obstaculizadas por cuestiones éticas relacionadas con las fuentes de células que impiden la aplicación de las CME humanas. Para evitar los conflictos éticos, se han hecho grandes esfuerzos para generar células similares a las CME humanas, que no se deriven de la masa celular interna de embriones. Una forma de soslayar esto, es inducir el estado pluripotente en las células somáticas por reprogramación directa
43,44.
De allí que, las células madre pluripotentes inducidas (iPSCs) se generan mediante la reprogramación de una célula somática diferenciada a una célula CME pluripotente. Es decir, se reprograma a una célula en su estado somático de nuevo a su estado embrionario
45.
Las iPSCs son un tipo de células madre con características pluripotenciales derivadas artificialmente de una célula que inicialmente no era pluripotencial. Por lo general, se utiliza una célula adulta diferenciada procedente de un tejido, sobre la que se induce la expresión de varios genes exógenos, tales como Oct4, Sox2, c-Myc y Klf4, capaces de des-diferenciarla. Se denomina reprogramación a esta des-diferenciación. En este sentido, se ha demostrado que las iPSCs pueden ser generadas a partir de fibroblastos de ratón adulto. Prueba de que, el principio de pluripotencia de las células madre puede ser generado a partir de células somáticas por la combinación de varios factores
43,44.
La reprogramación de los fibroblastos a células iPSCs plantea la posibilidad de que una célula somática podría ser reprogramada a un destino diferenciado alternativo sin convertirse primero una célula madre progenitora
46,47.
Tradicionalmente las células somáticas pueden ser reprogramadas a células pluripotentes : (a)Por la transferencia nuclear de células somáticas en oocitos, (b) Por factores expresados en células pluripotentes a través de la fusión celular y (c) Por integración genética y la combinación de diversos factores en la cromatina de células somáticas (d) Por la reprogramación directa
48,49.
En este sentido, los fibroblastos han sido ampliamente utilizados demostrándose a partir de ellos la obtención de diferentes linajes celulares, no solo a través de reprogramación directa a iPSCs y luego a células diferenciadas, sino también por reprogramación del linaje directamente, donde las células diferenciadas pueden obtenerse directamente induciendo a los fibroblastos a la sobreexpresión de factores de transcripción específicos del linaje celular
50 (Gráfico 1):
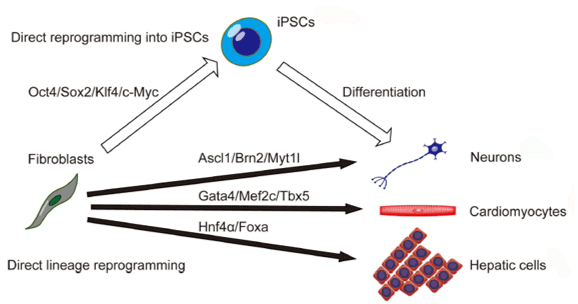 |
Gráfico 1
Generación de tipos celulares vía células madres pluripotentes inducidas (iPSC) y reprogramación de linaje directo50 |
Fibroblastos - Célula MadreLas células madre pluripotentes pueden ser generadas a partir de células somáticas por la combinación de un número de factores. Takahashi y cols.
51, generaron iPSCs a partir de células humanas adultas somáticas en condiciones de cultivo. Estos esfuerzos han permitido generar iPSCs de fibroblastos dérmicos adultos humanos y otras células somáticas humanas, que son comparables a las células CME humanas con potencial de diferenciación similar en morfología, proliferación, antígenos de superficie y expresión génica. Sin embargo, las iPSCs humanas no son idénticas a las ES humanas
43.
Fibroblasto - NeuronaEs concebible la conversión a diferentes tipos de células dentro del mismo linaje celular, pero la conversión a otros linajes puede ser desafiante. Se ha reportado que factores de transcripción específicos del linaje neuronal, convierten eficientemente a fibroblastos dérmicos de ratón a neuronas funcionales in vitro
50,52.
Fibroblastos - HepatocitosSe han convertido
53 fibroblastos de embriones y adultos de ratón en células que se parecen mucho a los hepatocitos in vitro. Las células hepatocitos inducidas (iHEP) tienen múltiples funciones específicas de hepatocitos, entre las que resaltan la reconstitución de los tejidos hepáticos dañados después del trasplante. La generación de células iHEP puede proporcionar conocimientos sobre la naturaleza molecular de la diferenciación de los hepatocitos y potenciales terapias para las enfermedades del hígado.
Fibroblastos - Progenitores SanguíneosSzabo y cols.
54, demostraron la capacidad de los fibroblastos humanos dérmicos de generar directamente células progenitoras y células maduras de linaje hematopoyético. La expresión ectópica de OCT4 (también llamado POU5F1) activado por factores de transcripción hematopoyéticos, junto con el tratamiento con citocinas específicas, generó células que expresaron el marcador CD45 pan-leucocitario. Estas células derivadas de fibroblastos dieron lugar a linajes de granulocitos, monocitos, megacariocitos y eritrocitos, y demostraron la capacidad de injerto in vivo.
Fibroblastos - CardiomiocitosIeda y cols.
55, informó que la combinación de tres factores de transcripción de desarrollo con rapidez y eficacia reprograman directamente fibroblastos cardíacos o dérmicos postnatales en células diferenciadas de tipo cardiomiocitos. Los cardiomiocitos inducidos expresan marcadores cardiacos específicos, tienen un perfil global de expresión de genes similares a los cardiomiocitos y se contraen espontáneamente. Estos hallazgos demuestran que los cardiomiocitos funcionales pueden ser reprogramados directamente a partir de células somáticas diferenciadas por factores definidos. La reprogramación de fibroblastos endógenos o explantados podría proporcionar una fuente de cardiomiocitos para enfoques regenerativos
54.
Fibroblasto - CondrocitosEn la búsqueda de fuentes alternativas de células condrocíticas la conversión de fibroblastos dérmicos a estas ha sido estudiada
56. La expresión de factores transcripcionales condrogénicos en fibroblastos dérmicos provoca la expresión de sus genes diana, que son marcadores de condrocitos, tales como colágeno de tipo II. Aunque los fibroblastos dérmicos representan una fuente de células fácilmente accesibles, la alta expresión de colágeno de tipo I de estos, es un gran obstáculo para la producción de cartílago hialino
57.
Hiramatsu y cols.
57, examinó si las células condrogénicas podrían ser inducidas directamente de cultivos de fibroblastos dérmicos de ratón adulto por la combinación de factores reprogramación condrogénicas. Indujeron líneas de células condrogénicas directamente del cultivo de fibroblastos dérmicos. Las células condrogénicas inducidas produjeron tejido cartilaginoso hialino homogéneo sin expresión de colágeno tipo I después de la inyección subcutánea en ratones desnudos
55,56. Este enfoque puede por lo tanto, ser un paso hacia la generación de cartílago hialino específico de la piel del paciente sin pasar por el proceso de generación de las iPSCs
46,47,55,56.
CONCLUSIÓNLas células estromales, tales como los fibroblastos, no solo son las células más comunes del tejido conjuntivo y responsable de la formación de las fibras y de la MEC, sino que también son células que se activan e interactúan de una manera dinámica con las células inmunes, así como, con los microorganismos que infiltran y/o sus componentes. De dicha interacción resulta la producción de citocinas proinflamatorias y antiinflamatorias, productos de mantenimiento o degradación de la MEC. Hallazgos que soportan el hecho participativo de los fibroblastos, por un lado en la inmunidad innata a través de la expresión de los TLRs y por otro lado, en la inmunidad especifica por su probable regulación de las células T por medio de la expresión de CD274, además de la expresión y producción de la enzima IDO que cataliza la degradación del triptófano, ocasionando la depleción de este a nivel local y en cuya ausencia el ciclo celular del linfocito T se detiene o entra en apoptosis.
El proceso de regeneración de los tejidos periodontales involucra la migración, proliferación y diferenciación de las células del LPD, para ello está sustentada la necesidad de una superficie radicular biocompatible que permita la recolonización de las células responsables de dicha regeneración. En este sentido, el acondicionamiento de la superficie radicular por agentes biocompatibles con las células del LPD, asi como, una superficie radicular libre de contaminantes surge como condicionantes para avanzar en terapias de regeneración periodontal.
En la remodelación periodontal inducida por fuerzas ortodoncicas la formación de hueso nuevo depende no solo de los osteoblastos, sino también de las células del LPD, las cuales exhiben potencial para diferenciarse hacia esa línea.
Las iPSCs generadas a partir de fibroblastos adultos humanos por reprogramación ofrecen utilidad no solo para la regeneración de tejidos y órganos, sino también para la comprensión de mecanismos de la enfermedad. Diversos hallazgos demuestran la restauración de multipotencia a partir de fibroblastos humanos, y sugieren un enfoque alternativo para la reprogramación celular en terapias autólogas de reemplazo celular que evita las complicaciones asociadas con el uso de células madre pluripotentes humanas. Teniendo además, aplicaciones como modelos para estudio de enfermedades, investigaciones básicas y posibles usos terapéuticos disminuyendo el rechazo en los trasplantes y sin la controversia del uso de embriones que tienen las células CME.
Sin duda, hay mucho que investigar en referencia al fibroblasto de los tejidos endo-periodontales; sin embargo, esta revisión ofrece una aproximación al conocimiento de esta célula altamente dinámica y funcional.
REFERENCIAS BIBLIOGRÁFICAS
- Konermann A, DCMEhner J, Allam JP, Novak N, Winter J, Baader SL, Jepsen S, Jäger A. Antigen-presenting cell marker expression and phagocytotic activity in periodontal ligament cells. J Oral Pathol Med. 2012;41(4):340-347.
- Konermann A, Stabenow D, Knolle PA, Held SA, DCMEhner J, Jäger A. Regulatory role of periodontal ligament fibroblasts for innate immune cell function and differentiation. Innate Immun. 2012;18(5):745-752.
- Sun Y, Shu R, Li CL, Zhang MZ. Gram-negative periodontal bacteria induce the activation of Toll-like receptors 2 and 4, and cytokine production in human periodontal ligament cells. J Periodontol. 2010;81(10):1488-1496.
- Hans M, Hans VM. Toll-like receptors and their dual role in periodontitis: a review. J Oral Sci. 2011;53(3):263-271.
- Hirao K, Yumoto H, Takahashi K, Mukai K, Nakaishi T, Matsuo T. Roles of TLR2, TLR4, NOD2, and NOD1 in pulp fibroblasts. J Dent Res. 2009;88(8):762-7.
- El-Awady AR, Messer RL, Gamal AY, Sharawy MM, Wenger KH, Lapp CA. Periodontal ligament fibroblasts sustain destructive immune modulators of chronic periodontitis. J Periodontol. 2010;81(9):1324-35.
- Corotti MV, Zambuzzi WF, Paiva KB, Menezes R, Pinto LC, Lara VS, Granjeiro JM. Immunolocalization of matrix metalloproteinases-2 and -9 during apical periodontitis development. Arch Oral Biol. 2009;54(8):764-71.
- Biswas C, Zhang Y, DeCastro R, Guo H, Nakamura T, Kataoka H, Nabeshima K. The human tumor cell-derived collagenase stimulatory factor (renamed EMMPRIN) is a member of the immunoglobulin superfamily. Cancer Res. 1995;55(2):434-9.
- Dong W, Xiang J, Li C, Cao Z, Huang Z. Increased expression of extracellular matrix metalloproteinase inducer is associated with matrix metalloproteinase-1 and -2 in gingival tissues from patients with periodontitis. J Periodontal Res. 2009;44(1):125-32.
- Gaffen SL, Hajishengallis G. A new inflammatory cytokine on the block: re-thinking periodontal disease and the Th1/Th2 paradigm in the context of Th17 cells and IL-17. J Dent Res. 2008;87(9):817-28.
- Takahashi K, Azuma T, Motohira H, Kinane DF, Kitetsu S. The potential role of interleukin-17 in the immunopathology of periodontal disease. J Clin Periodontol. 2005;32(4):369-74.
- Wu Y, Zhu L, Wei H, Peng B. Regulation of matrix metalloproteinases, tissue inhibitor of matrix metalloproteinase-1, and extracellular metalloproteinase inducer by interleukin-17 in human periodontal ligament fibroblasts. J Endod. 2013;39(1):62-7.
- Andonovska B, Dimova C, Panov S. Matrix metalloproteinases (MMP-1, -8, -13) in chronic periapical lesions. Vojnosanit Pregl. 2008;65(12):882-6.
- Hahary A, Li Y, Tredget EE, Kilani RT, Iwashina T, Karami A, Lin X. Expression of indoleamine 2,3-dioxygenase in dermal fibroblasts functions as a local immunosuppressive factor. J Invest Dermatol. 2004;122(4):953-964.
- Nisapakultorn K, Makrudthong J, Sa-Ard-Iam N, Rerkyen P, Mahanonda R, Takikawa O. Indoleamine 2,3-dioxygenase expression and regulation in chronic periodontitis. J Periodontol. 2009;80(1):114-121.
- Adams O, Besken K, Oberdörfer C, MacKenzie CR, Rüssing D, Däubener W. Inhibition of human herpes simplex virus type 2 by interferon gamma and tumor necrosis factor alpha is mediated by indoleamine 2,3-dioxygenase. Microbes Infect. 2004;6(9):806-812.
- Mahanonda R, Sa-Ard-Iam N, Montreekachon P, Pimkhaokham A, Yongvanichit K, Fukuda MM, Pichyangkul S. IL-8 and IDO expression by human gingival fibroblasts via TLRs. J Immunol. 2007;178(2):1151-1157.
- Konermann A, Beyer M, DCMEhner J, Allam JP, Novak N, Winter J, Jepsen S, Jäger A. Human periodontal ligament cells facilitate leukocyte recruitment and are influenced in their immunomodulatory function by Th17 cytokine release. Cell Immunol. 2012;272(2):137-143.
- Bosshardt DD, Sculean A. Does periodontal tissue regeneration really work? Periodontol 2000. 2009;51:208-19.
- Kasaj A, Röhrig B, Zafiropoulos GG, Willershausen B. Clinical evaluation of nanocrystalline hydroxyapatite paste in the treatment of human periodontal bony defects- a randomized controlled clinical trial: 6-month results. J Periodontol. 2008; 79(3):394-400.
- Mariotti A. Efficacy of chemical root surface modifiers in the treatment of periodontal disease. A systematic review. Ann Periodontol. 2003;8(1):205-26.
- Trombelli L. Which reconstructive procedures are effective for treating the periodontal intraosseous defect?. Periodontol. 2000; 37:88-105.
- Pitaru S, Soldinger M, Madgar D, Metzger Z. Bacterial endotoxin inhibits migration, attachment, and orientation of human gingival fibroblasts in vitro and delays collagen gel contraction. J Dent Res. 1987;66(9):1449-55.
- Pant V, Dixit J, Agrawal AK, Seth PK, Pant AB. Behavior of human periodontal ligament cells on CO2 laser irradiated dentinal root surfaces: an in vitro study. J Periodont Res. 2004;39(6):373-9.
- Polson AM, Frederick GT, Ladenheim S, Hanes PJ. The production of a root surface smear layer by instrumentation and its removal by citric acid. J Periodontol. 1984;55(8):443-6.
- Babay N. The effect of EDTA on the attachment and growth of cultured human gingival fibroblasts in periodontitisaffected root surface. J Contemp Dent Pract. 2001;2(1):13-23.
- Silvério KG, Martinez AE, Rossa C Jr. Effects of basic fibroblast growth factor on density and morphology of fibroblasts grown on root surfaces with or without conditioning with tetracycline or EDTA. J Oral Sci. 2007;49(3):213-20.
- Blomlöf J, Lindskog S. Root surface texture and early cell and tissue colonization after different etching modalities. Eur J Oral Sci. 1995;103(1):17-24.
- Kasaj A, Klein MO, Dupont J, Willershausen B, Krahn U, Götz H, Zeiler J, Brüllmann D, Duschner H. Early root surface colonization by human periodontal ligament fibroblasts following treatment with different biomaterials. Acta Odontol Scand. 2013;71(6):1579-87.
- Krishnan V, Davidovitch Z. Cellular, molecular, and tissuelevel reactions to orthodontic force. American Journal of Orthodontics and Dentofacial Orthopedics. 2006;129(4):469.e1-32.
- Krishnan V, Davidovitch Z. On a path to unfolding the biological mechanisms of orthodontic tooth movement. Journal of Dental Research. 2009;88(7):597-608.
- Murakami Y, Kojima T, Nagasawa T, Kobayashi H, Ishikawa I. Novel isolation of alkaline phosphatase-positive subpopulation from periodontal ligament fibroblasts. J Periodontol. 2003;74(6):780-6.
- Kook SH, Hwang JM, Park JS, Kim EM, Heo JS, Jeon YM, Lee JC. Mechanical force induces type I collagen expression in human periodontal ligament fibroblasts through activation of ERK/JNK and AP-1. J Cell Biochem. 2009;106(6):1060-7.
- Piche JE, Carnes Jr DL, Graves DT. Initial characterization of cells derived from human periodontia. J Dent Res. 1989;68(5):761-7.
- Grunheid T, Zentner A. Extracellular matrix synthesis, proliferation and death in mechanically stimulated human gingival fibroblasts in vitro. Clin Oral Investig. 2005;9(2):124-30.
- Jacobs C, Grimm S, Ziebart T, Walter C, Wehrbein H. Osteogenic differentiation of periodontal fibroblasts is dependent on the strength of mechanical strain. Arch Oral Biol. 2013;58(7):896-904.
- Aumailley M, Gayraud B. Structure and biological activity of the extracellular matrix. J Mol Med (Berl). 1998;76(3-4):253-65.
- Mamalis A, Markopoulou C, Lagou A, Vrotsos I. Oestrogen regulates proliferation, osteoblastic differentiation, collagen synthesis and periostin gene expression in human periodontal ligament cells through oestrogen receptor beta. Arch Oral Biol. 2011;56(5):446-55.
- Lossdörfer S, Götz W, Jäger A. PTH(1-34)-induced changes in RANKL and OPG expression by human LPD cells modify osteoclast biology in a co-culture model with RAW 264.7 cells. Clin Oral Investig. 2011; 15(6):941-52.
- Nokhbehsaim M, DCMEhner B, Winter J, Reimann S, Bourauel C, Jepsen S, Jäger A, DCMEhner J. Contribution of orthodontic load to inflammation-mediated periodontal destruction. J Orofac Orthop. 2010;71(6):390-402.
- Yamanaka, S. Strategies and new developments in the generation of patient-specific pluripotent stem cells. Cell Stem Cell. 2007;1(1):39-49.
- Amabile G, Meissner A. Induced pluripotent stem cells: current progress and potential for regenerative medicine. Trends Mol Med. 2009;15(2):59-68.
- Takahashi K. and Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006;126(4):663-676.
- Maherali N, Sridharan R, Xie W, Utikal J, Eminli S, Arnold K, Stadtfeld M, Yachechko R, Tchieu J, Jaenisch R, Plath K, Hochedlinger K. Directly reprogrammed fibroblasts show global epigenetic remodeling and widespread tissue contribution. Cell Stem Cell. 2007 Jun 7;1(1):55-70.
- Hochedlinger K, Plath K. Epigenetic reprogramming and induced pluripotency. Development. 2009;136(4):509-23.
- Svendsen CN. Back to the future: how human induced pluripotent stem cells will transform regenerative medicine. Hum Mol Genet. 2013;22(1):32-8.
- Sareen D, Svendsen CN. Stem cell biologists sure play a mean pinball. Nat Biotechnol. 2010;28(4):333-5.
- Do JT, Schöler HR. Cell-cell fusion as a means to establish pluripotency. Ernst Schering Res Found Workshop. 2006;(60):35-45.
- Patel M, Yang S. Advances in reprogramming somatic cells to induced pluripotent stem cells. Stem Cell Rev. 2010;6(3):367-80.
- Ieda M. Direct reprogramming into desired cell types by defined factors. Keio J Med. 2013;62(3):74-82.
- Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 2007;131(5):861-72.
- Zou Q, Yan Q, Zhong J, Wang K, Sun H, Yi X, Lai L. Direct conversion of human fibroblasts into neuronal restricted progenitors. J Biol Chem. 2014;289(8):5250-60.
- Sekiya S, Suzuki A. Direct conversion of mouse fibroblasts to hepatocyte-like cells by defined factors. Nature. 2011;475(7356):390-3.
- Szabo E, Rampalli S, Risueño RM, Schnerch A, Mitchell R, Fiebig-Comyn A, Levadoux-Martin M, Bhatia M. Direct conversion of human fibroblasts to multilineage blood progenitors. Nature. 2010;468(7323):521-6.
- Ieda M, Fu JD, Delgado-Olguin P, Vedantham V, Hayashi Y, Bruneau BG, Srivastava D. Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell. 2010;142(3):375-86.
- Sudo K, Kanno M, Miharada K, Ogawa S, Hiroyama T, Saijo K, Nakamura Y. Mesenchymal progenitors able to differentiate into osteogenic, chondrogenic, and/or adipogenic cells in vitro are present in most primary fibroblast-like cell populations. Stem Cells. 2007;25(7):1610-1617.
- Hiramatsu K, Sasagawa S, Outani H, Nakagawa K, Yoshikawa H, Tsumaki N. Generation of hyaline cartilaginous tissue from mouse adult dermal fibroblast culture by defined factors. J Clin Invest. 2011 Feb;121(2):640-57.
|
