Trabajos Originales
Efecto de la combinación de dieta hiperlipídica y la privación de estrógeno sobre la integridad ósea bucal de ratas
Recibido para Arbitraje: 18/08/2014
Aceptado para Publicación: 03/11/2014Silvio Sandro Cornélio, Maestro en Fisiopatologia - Universidad del Estado de Rio de Janeiro, Rio de Janeiro, Brasil/UERJ. Celly Cristina Alves do Nascimento-Saba, Maestra y Doctora en Fisiologia, Universidad del Estado de Rio de Janeiro, Rio de Janeiro, Brasil/UERJ. Gabrielle de Paula Lopes Gonzalez, Maestra en Fisipatologia, Universidad del Estado de Rio de Janeiro, Rio de Janeiro, Brasil/UERJ. Victor Jayme Roget Rodriguez Pita, Maestro y Doctor en tecnología de Polymeros, Universidad Federal de Rio de Janeiro, Rio de Janeiro, Brasil/ UFRJ. Mariana dos Santos Ribeiro, Estudiante de Biologia - Universidad del Estado de Rio de Janeiro, Rio de Janeiro, Brasil/UERJ. Aline Souza Santos, Estudiante de Biologia, Universidad del Estado de Rio de Janeiro, Rio de Janeiro, Brasil/UERJ. Aluana Santana Carlos, Universidad del Estado de Rio de Janeiro, Rio de Janeiro, Brasil/UERJ.
CORRESPONDENCIA
Silvio Sandro Cornélio. E-mail: silviosandro@uerj Adress: Rua São Francisco Xavier, 524 Pav. Haroldo Lisboa - 415, CEP 20550900 , Rio de Janeiro - RJ. Brasil.
EFECTO DE LA COMBINACIÓN DE DIETA HIPERLIPÍDICA Y LA PRIVACIÓN DE ESTRÓGENO SOBRE LA INTEGRIDAD ÓSEA BUCAL DE RATAS
RESUMEN
El objetivo de este estudio fue evaluar Se evaluó el efecto de la deficiencia de estrógenos asociada con dieta hiperlipídica sobre la integridad de la mandíbula de ratas.
Para este experimento se selecionaron Ratas Wistar fueron divididas en 4 grupos: Control (C4%), Control hiperlipídica19% (C19%), ovariectomizadas 4% (OVX4%) y Ovariectomizada 19% (OVX19%). El experimento empezó con la castración (90 días), seguida de dieta hiperlipídica durante 30 días. Al fin, la sangre fue recogida para el análisis de los niveles séricos de calcio, fósforo, fosfatasa alcalina y estradiol.
El fósforo disminuyó cuando hay aumento de la fosfatasa alcalina en todos los grupos en comparación con el C4%. En las vértebras L4, los pesos inmersos y húmedos aumentarán con la castración y la dieta hiperlipídica, mientras que el porcentaje de materia orgánica y minerales disminuyeron. En las mandíbulas, los pesos inmersos, húmedos y la densidad ósea aumentaran con la castración, pero disminuyeron con la combinación de castración / dieta. En las cenizas de las mandíbulas, el porcentaje de magnesio aumentó significativamente en todos los grupos. En las pruebas biomecánicas de las vértebras L4 y fémur no se encontraron diferencias significativas entre los grupos. Sin embargo, los grupos alimentados con dieta hiperlipídica tuvieron una menor resistencia a la tensión aplicada en la mandíbula. Dentro de las limitaciones del estudio, se puede notar que en estas ratas, la deficiencia de esteroides sexuales asociada con la dieta hiperlipídica influye negativamente sobre la integridad del hueso mandibular.
PALABRAS CLAVE: Integridad ósea, dieta hiperlipídica, ovariectomia, análisis biomecánico y aceite de soya
EFFECT OF ASSOCIATION HIGH FAT DIET, HYPOESTROGENISM ON BONE INTEGRITY OF ORAL RATS
SUMMARY
The aim of this study was to evaluate the effect of estrogen deficiency associated with a high fat diet on bone integrity of the jaw of rats. The pregnant rats were evaluated by vaginal cytology were 90 days old, divided into four groups: Control (C4%), Control hiperlipídica19% (C19%), ovariectomized 4% (OVX4%) and Ovariectomized19% (OVX19%). The experiment began with castration (90 days), followed by feeding with a high fat diet for 30 days. At the end, blood was collected. Jaws, vertebrae L4 and femur were removed and prepared for analysis. There were no differences in food intake, the body length or in bone measurements. Serum calcium decreased in the castrated groups. The level of phosphorus decreased and alkaline phosphatase increased in all groups. Some differences were observed among physical parameters. L4 vertebrae, immersed and wet weights increased with castration and the high fat diet, while the percentage of organic material and mineral decreased. In the jaws, immersed and wet weights and bone density increased with castration, but decreased with the combination spaying/fat diet. Bone volume and percentage of water decreased with intake of high fat diet. In the ashes of the jaws percentages of magnesium were increased in all groups, without changes in calcium and phosphorus. Groups fed with high-fat diets had lower resistance to the applied voltage in the jaw. It was demonstrated in these rats that, the deficiency of sex steroids associated with a high fat diet negatively influences mandibular bone integrity.
KEY WORDS: bone integrity, high fat diet, ovariectomy, biomechanical tests and soy oil. |
Un gran desafío para el hombre en este nuevo siglo está en convivir con los cambios de la sociedad, entre ellos los hábitos alimentares, que llaman la atención de los profesionales del área biomédica. La ingestión de dietas ricas en hidratos de carbono y lípidos, representa un cambio en el estilo de vida que suelen resultar en aumento de masa corporal y aparición de comorbilidades que afectan a otros órganos y sistemas del cuerpo, dando lugar a efectos perjudiciales, como las enfermedades neurodegenerativas, complicaciones cardiovasculares, el síndrome metabólico y enfermedades óseas
1,2 . Datos del Instituto Brasileño de Geografía y Estadística (IBGE) "Síntesis de indicadores sociales: un análisis de las condiciones de vida de la población brasileña - 2009" demuestran claramente que el envejecimiento de la población brasileña es una evidencia demográfica, y que este nuevo paradigma sigue en curso y merece políticas específicas publicas adecuadas al nuevo perfil etario. Con el envejecimiento, la pérdida de la función gonadal, que se caracteriza en las mujeres posmenopáusicas, proporciona un menor gasto de energía, disminución de la masa magra y un estímulo para la acumulación de grasa, lo que aumenta el riesgo de obesidad y enfermedades cardiovasculares
3. Estos cambios en conjunto con las alteraciones alimenticias tienen un mayor impacto en la salud de las mujeres posmenopáusicas
4,5. La deficiencia de las concentraciones séricas de esteroides sexuales, especialmente el estradiol promueve una serie de cambios metabólicos que, sumados a los antiguos hábitos de alimentación y actividad física, conduce a una mayor vulnerabilidad y pérdida de calidad ósea
6.
El tratamiento odontológico después de la menopausia en las mujeres que consumen dieta hiperlipídica, merece una atención especial, sobre todo cuando se trata de procedimientos que se relacionan directamente con la estructura del hueso debido a los cambios que puedan surgir en el tejido.
MATERIALES Y MÉTODOSRatas adultas, ratas, criadas y mantenidas en el Laboratorio de Fisiología Animal y endocrina, UERJ, tuvieron libre acceso al agua y al alimento comercial , ración agroceres® para ratas, São Paulo - SP , que contiene como niveles de garantía: Humedad (máx) 13% , Proteína cruda (mínimo) 22% , Extracto Etéreo (mínima) 4% , La materia fibrosa (máximo) 8% , Materia mineral (máximo) 9% , Calcio (Max) 1,40% , Fósforo (mínimo) 0.80%. Descripción de los ingredientes en la ración: cloruro de sodio (sal común); maíz integral; La harina de soja; El salvado de trigo; Fosfato dicálcico; Carbonato de calcio; DL-metionina; L-lisina HCL; aditivo antioxidante; Mineral y Vitamina Premezcla hasta el comienzo del experimento. El experimento empezó con la castración a los 90 días de edad, y con ratas previamente evaluadas por quince días consecutivos, mediante citología vaginal, que certifica el funcionamiento del ovario.
El protocolo experimental evaluó la ingesta de ración purificada (AIN 93M), que contiene 19% de aceite de soya/100g de ración (hiperlipídica) durante 30 días después de la castración. La ración del control se fabricó con aceite de soya, con contenido de 4% de aceite de soya. Si prepararan las raciones en acuerdo con AIN9311
7 Para este diseño experimental, se formaron cuatro grupos: Control (C4%, n = 7): las ratas alimentadas con una ración normolipídica con contenido de 4% de lipidos en el aceite de soya. Control de 19% (C19%, n = 11): ratas alimentadas con ración hiperlipídica con 19% de aceite de soya. Ovariectomizado 4% (OVX4%, n = 11): ratas castradas alimentadas con una ración normolipídica con contenido de 4% de aceite de soya. Ovariectomizado 19% (OVX19 %, n = 11): ratas castradas alimentadas con ración hiperlipídica con contenido de 19% de aceite de soya. A finales de los 30 días de la ingestión, las ratas fueron sacrificadas por desangrado bajo anestesia con Tiopental (0,2ml/100gPC) y la sangre y huesos fueron recogidos para su análisis.
CITOLOGÍA VAGINAL: Se llevó a cabo durante quince días y empezó a los 75 días de edad. Se recogió los frotis vaginales utilizando pipetas Pasteur y solución salina considerando ratas experimentales, las que mostraron ciclo estral normal. Ovariectomía: La extirpación bilateral de los ovarios, bajo anestesia con Tiopental (0,2ml/100gPC). Las ratas del grupo control experimentó sólo el estrés quirúrgico. Colección de sangre y tejido: La sangre fue colectada por punción cardiaca. Las mandíbulas, fémures y vértebras lumbares L4 fueron extirpados, pesados y almacenados en solución salina a 20 ° C para su posterior análisis.
EVALUACIÓN DEL SUERO: Se utilizó para la determinación de calcio, fósforo y fosfatasa alcalina por el método colorimétrico, utilizando kits comerciales (Bioclin). Las concentraciones séricas de estradiol se determinaron por radioinmunoensayo específicos utilizando kit comercial (MP Biomedicals, CA, EE.UU.). Medidas del hueso: la altura del cuerpo vertebral (L4) sentido Oro-caldal, la longitud y el diámetro del fémur derecho y las distancias mesiodistal (MD) y vestibulolingual (VL), de la mitad derecha de la mandíbula se midieron con un calibrador. ENSAYO FÍSICO: Después de la escisión, fémur, la mitad derecha de la mandíbula y la vértebra se mantuvieron en una solución salina a - 10o C para su posterior análisis. Ensayo Biomecánico: para la prueba de biomecánica, los valores de la carga aplicada se describieron en función de la tensión registrada en el software de la máquina. Prueba de compresión de las vértebras: Para la compresión de las vértebras fueron retiradas las apófisis transversas, espinosas y los arcos vertebrales, obteniendo así el cuerpo vertebral. Ensayo de flexión de tres puntos en el fémur: El fémur se colocó sobre dos rodillos para alcansar el apoyo, siendo el tercer punto en el medio de la diáfisis. Ensayo de flexión en tres puntos de mandíbulas:
Las mandíbulas han sido posicionadas con los molares hacia arriba. Los extremos de la mandíbula se apoyaran en los rodillos, formando dos puntos. El tercer punto fue el sitio de la fractura inmediatamente después de la parte distal del tercer molar. El análisis del contenido de cenizas: se analizaron en el Laboratorio de Caracterización del Centro de Catálisis NUCAT/ PEQ/COPPE/UFRJ. Las cenizas fueron analizadas por espectrómetro de fluorescencia de Rx. El análisis estadístico: Los resultados fueron sometidos a análisis de varianza (ANOVA), seguidos de pruebas de comparación múltiples. Todos los resultados fueran expresos como error satandard y media, teniendo en cuenta el nivel de significación de p <0,05.
RESULTADOSCONSUMO ALIMENTARIONuestro estudio no ha encontrado una correlación entre la baja de estrógenos y/o la dieta hiperlipídica, con el tamaño del cuerpo o con la ingesta de alimentos, no habiendo diferencias significativas entre los grupos, como lo que confirma los informes
8.
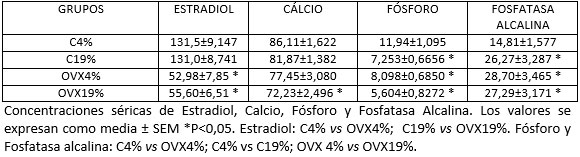
Para el calcio y el fósforo, la pérdida de la función gonadal fue un factor determinante para su disminución, lo que confirma estudios previos
9,10,11,12. Hubo disminución de los niveles séricos de estradiol, calcio y de fósforo y aumento de los niveles de fosfatasa alcalina en suero (TABLA 1).
TABLA 1
EVALUACIÓN SÉRICA |
 |
|
MEDIDAS ÓSEASMedidas de la vértebra L4, fémur y mandíbula: no hubo diferencias significativas en los prámetros evaluados para las medidas tomadas (tamaño, diámetro, ancho, alto y espesor) En el análisis de parámetros físicos, se encontraron diferencias significativas en el peso sumergido de las vértebras (C4%vsOVX4%; C4%vsOVX19%) y mandíbulas (peso húmedo de las vértebras y mandíbulas, volumen óseo de la mandíbula).
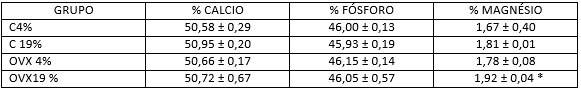
CENIZASPara las cenizas de las mandíbulas, hubo diferencia significativa para el percentual de Magnesio, que se presentó aumentado en el grupo OVX19%. (TABLA 2).
TABLA 2
PORCENTAJES de Ca, P y Mg EN LAS CENIZAS DE LAS MANDÍBULAS. |
 |
|
Evaluación del porcentaje de Ca, P y Mg en las cenizas de la mandíbula (ración normolipídica 4%) o aceite de soja 19% (ración hiperlipídica) en ratas deficientes en los esteroides sexuales, inducidas por la ovariectomía bilateral (OVX4 % y% OVX19) y en los grupos control que recibían las mismas raciones (C4% y C19%). Los valores se expresan como media ± SEM, * p <0,05,% frente a C4%.
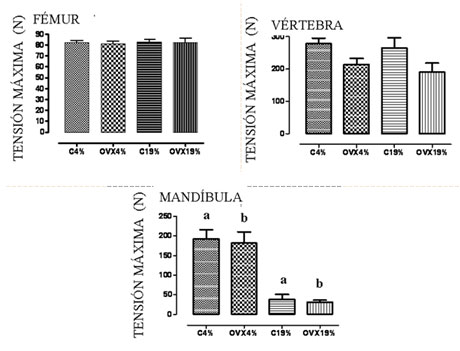
EVALUACIÓN BIOMECÁNICAEn el fémur y vértebras L4 no se encontraron diferencias significativas entre los grupos. Para lãs mandíbulas, diferentemente, podemos observar alteraciones entre los grupos C4% vs C19%, C4% vs OVX19%; OVX4% vs OVX19% y OVX4%vsOVX19%. (FIGURA 1).
FIGURA 1
PRUEBA BIOMECÁNICA |
 |
|
Figura 1: Prueba Tensión máxima en el fémur, vértebra L4 y la mandíbula en ratas con deficiencia de los esteroides sexuales (OVX) y (c) los controles después de la ingestión de alimentos que contienen fabricado 4% (normolipídica) o el 19% soya (aceite de la grasa). Expresan estos valores como media ± SEM, * p <0,05,%
DISCUSIÓNCom la gran cantidad de lípidos y la ingesta de carbohidratos durante las comidas, la gente se queda cada vez menos sana y sujetas a los efectos nocivos de esto tipo de alimentación. El consumo frecuente de estos nutrientes y el aumento de masa corporal, seguido por una serie de cambios metabólicos llevan a la obesidad y sus complicaciones
13. Las co-morbilidades mas asociadas con la obesidad están bien caracterizadas en la definición del síndrome metabólico, además de las enfermedades óseas
14,15, como la osteoporosis, que afectan también las mujeres obesas
16,17. Junto con el consumo excesivo de alimentos ricos en lípidos, la pérdida de la función gonadal contribuye aún más a los efectos nocivos de la pérdida de la calidad ósea, ya que el hipoestrogenismo está asociado a la osteoporosis
3. El aumento de la esperanza de vida y la disponibilidad de recursos tecnológicos y terapéuticos han permitido a las mujeres a vivir más tiempo y por lo tanto con los efectos de la pérdida de la función gonadal. La asociación de los dos componentes, el hipoestrogenismo y la dieta hiperlipídica pueden llevar a alteraciones metabólicas más graves, ya que solo la obesidade induce la producción de una serie de sustancias pro-inflamatorias que se asocian con la pérdida de la integridad ósea
3,18,19,20. Tradicionalmente, los huesos evaluados en la osteoporosis son el fémur y la cuarta vértebra lumbar (L4)
20, por seren los primeros sitios de expresión de la fragilidad ósea. Sin embargo, esta enfermedad afecta a todos los huesos del cuerpo en diferentes niveles y en diferentes períodos de tiempo, lo que lleva a la pérdida de la integridad ósea
21. El hueso mandibular no es ampliamente estudiado bajo estas condiciones, por poseer una constitución predominantemente cortical, además de la enfermedad periodontal afectar a los dientes, incluyendo también la mandíbula, interactuando con el curso natural de la osteoporosis, y viceversa
22. En nuestro modelo experimental, la asociación de la dieta hiperlipídica con la ovariectomia mostró resultados que nos llevan a conjeturar la hipótesis de una acción más perjudicial para el hueso. Los efectos nocivos de la deficiencia de estradiol se determinaron mediante la extirpación quirúrgica bilateral de los ovarios. Los niveles séricos bajos de estradiol observados en los animales ovariectomizadas confirman el hipogonadismo, imitando la menopausia natural
23,24. La pérdida de los esteroides sexuales y / o la ingesta de dietas sabrosas, como las dietas hiperlipídicas se asocian con un aumento de masa corporal
25,27,. Ikemoto
29 demostró un aumento de peso corporal en ratones alimentados con aceite de soja, como en nuestro laboratorio. Estudio reciente, mediante dieta rica en aceite de pescado (rico en ácidos grasos n-3), encontró resultados similares
30. A pesar del aumento en la masa corporal ser bien descrito, en este estudio no se encontró ninguna correlación entre la privación de estrógeno y/o la dieta hiperlipídica, con la extensión corporal o con la ingesta de alimentos. En nuestros estudios, la evaluación indirecta de la integridad ósea determinada a partir de las concentraciones séricas de calcio, fósforo y fosfatasa alcalina mostró que la deficiencia de esteroides sexuales e ingesta de dieta hiperlipídica son factores que afectan la estructura ósea. En relación al calcio y fósforo, la pérdida de la función gonadal ha sido un factor determinante para su reducción, lo que confirma los relatos anteriores
11,12. La combinación de los resultados de la ovariectomía con el consumo de dieta hiperlipídica determinó una mayor disminución en el calcio sérico, posiblemente por el efecto de la dieta en reducir de la absorción intestinal de calcio
35. En relación a las medidas adoptadas en las mandíbulas, fémures y vértebras L4 es posible que la falta de alteraciones se justifique por el corto período de experimentación. Recientemente detectamos cambios que indican una reducción de las medidas mandibulares en ratas después de períodos de deficiencia crónica de esteroides sexuales 36. Sin embargo, estos parámetros son muy poco utilizados 38,39, aunque sea indicador de cambios morfológicos. Las ateraciones en algunos parámetros físicos de las vértebras L4 y mandíbulas pueden ser atribuidas al efecto de la dieta sobre la estructura ósea.
Las alteraciones anatómicas de diámetros y tamaños de los canales medulares y del canal mandibular, fueran evidenciadas principalmente en los grupos OVX. La disminución en el porcentaje de material orgánico de las vértebras, en los animales C19% y OVX 19% se correlacionan con las concentraciones séricas de fósforo y calcio. Las densidades minerales óseas de las mandíbulas, en los animales castrados, muestran la influencia directa de la privación de estrógenos. En el fémur, el mantenimiento de estos parámetros, al igual que el control se producen, posiblemente por este ser un hueso cortical y por el hecho del período de prueba de un mes fue corto para inferir cambios. El análisis del contenido de minerales se realizó solamente en las cenizas de las mandíbulas que no ha mostrado ninguna alteración en el calcio y fósforo. Sorprendentemente, el porcentaje de magnesio fue mayor en el grupo de OVX19%. Mitad del magnesio del cuerpo se encuentra en los huesos y la otra en músculos y otros tejidos40. Encontramos niveles más altos de magnesio correlacionando con la dieta hiperlipídica, ya que hubo un aumento en los grupos de OVX19% y C19%. La evaluación de la integridad ósea a través de pruebas biomecánicas han sido descritas en términos de carga aplicada al cuerpo de prueba
41. Evaluamos la tensión máxima y la carga máxima llevando en cuenta la medida de una carga o fuerza aplicada, normalizado para ubicar el área transversal, además de la intensidad de la deformación inducida por una tensión
42. No hubo alteraciones en las vertebras ni en el fémur. Para el último, por su naturaleza principalmente cortical y el corto tiempo de prueba. Sorprendentemente, las mandíbulas respondieron de manera diferente posiblemente por las variables anatómicas y/o distribución de la fuerza masticatoria, que en roedores es mayor en la región anterior y en humanos en la región posterior de la mandíbula. El grupo OVX19% mostró claramente menor resistencia a la tracción y la carga máxima, de acuerdo con la menor densidad ósea, observada en la prueba física. Cabe destacar que la prueba biomecánica expresa una fragilidad ósea claramente visibles cuando hay una asociación de la dieta hiperlipídica con el hipoestrogenismo. Este tipo de evaluación, teniendo en cuenta no sólo la carga máxima, sino también el grosor del hueso en el sitio de la fractura se realizó por primera vez en este modelo experimental. Así, para este modelo experimental, se observó que existe una correlación negativa entre la dieta hiperlipídica asociada con la privación de estrógenos. La dieta influenció negativamente la integridad ósea exacerbando lo que ya ocurre naturalmente en la pérdida de la función gonadal: una mayor absorción ósea.
CONCLUSIÓNSe demostró que la deficiencia de esteroides sexuales asociada con la dieta hiperlipídica influye negativamente sobre la integridad del hueso mandibular, a pesar de non detectar en esto período diferencias en las medidas óseas.
AGRADECIMIENTOSAgradecemos al Sr Carlos Alberto por los cuidado con los animales. A Nathália Borges del NUCAT( Núcleo de catalisisde la Universidad Federal de Rio de Janeiro (UFRJ) el analisis de las cenizas. A Victor Pita del Instituto de Macromoleculas - IMA de la Universidad Federal de Rio de Janeiro (UFRJ) ,Ricardo Hudson del Instituto Politécnico de Rio de Janeiro(IPRJ) por la oportunidad de realizar los analisis biomecánicos de las mandíbulas, vertebras y fémures. A la Fundación Carlos Chagas Filho de Amparo a la Pesquisa de la Provincia de Rio de Janeiro (FAPERJ-Brazil) por el auxílio financeiro, lo que permitió la realización del trabajo.
REFERENCIAS BIBLIOGRÁFICAS
- Takeda S, Karsenty G. Molecular bases of the sympathetic regulation of bone mass. Bone 2008; 42 (5): 837-40.
- Maury E, Brichad SM. Adipokines disregulation adipose tissue inflammation and metabolic syndrome. Mol Cell Endocrinol 2010; 314 (1):1-16.
- Ohta, H, Kuroda T, Onoe Y, Orito S, Ohara M, Kume M, Harada A, Tsugawa N, Okano T, Sasaki S. The impact of lifestyle factors on serum 25-hydroxyvitamin D levels: a cross - sectional study in japanese women aged 19-25 years. J Bone Miner Metab 2009; 27(6): 682-88.
- França AP, Aldrighi JM, Marucci MFN. Fatores associados à obesidade global e à obesidade abdominal em mulheres na pós-menopausa. Bras Saúde Matern Infant 2008; 8 (1): 65-73.
- Izmozherova NV, Popov AA. Postmenopausal osteoporosis in obese women. Klin Med (Mosk) 2008; 86 (3): 44-6.
- Zhang L, Keung W, Samokhvalov V, Wang W, Lopaschuk GD. Role of fatty acid uptake and fatty acid beta oxidation in mediating insulin resistance in heart and skeletal muscle. Biochim Biophs Acta 2010; 1801 (1): 1-22.
- Reeves PG. Components of the AIN-93 diets as improvements in the AIN.76A diet.. J Nutr 1997; 127 (5 suppl):838S-841S.
- Duarte ACGO, Fonseca DF, Manzoni MSJ, Soave CF, Siene-Fiorese M, Dâmaso AR,, Cheik NC. High fat diet and secretory capacity of insulin in rats. Rev Nut. 2006; 19 (3): 341-48.
- Shulz S SR, Morris HA. Ionized calcium and bone turnover in the estrogen deficient rat. Calcif Tissue Int. 1999; 65(1): 78-82.
- Tenório AS, Alves SB, Bezerra AL, Souza GML, Catanho MTJA, Tashiro T, Galindo LCM, Moraes SRA de. Efeito do treinamento físico sobre o tecido ósseo e a concentração sérica de cálcio em camundongos fêmea e ovariectomizadas. Acta Cir Bras. 2005; 20 (4): 280-83.
- Murthy P,SN, Sengupta S, Sharma S, Singh MM. Effect of ormeloxifone an ovariectomy induced bone resorption, osteoclast differentiation and apoptosis and TgF beta-3 expression. J Steroid Biochem Mol Biol. 2006; (100): 117-128.
- Huang Z, Shi G, Gao F, Zhang Y, Liu X, Christopher TA, Lopes B, Ma XL. Effects of N - n-buttyl haloperidol iodile on L-type calcium channels and intracellular free calcium in rat ventricular myocytes. Biochem Cell Biol 2007 85(2): 182-8.
- Moro C, Pillard F, Glisezinsk I, Crampes F, Thalamas C, Harant I, Marques MA, Lafontan M, Berlan M. Sex differences in lipolysis-regulating mechanisms in overweigh subjects: effect of exercise intensity . Obesity. 2007; 15 (9): 2545-55.
- Matsuzawa Y, Shimomura I, Kihara S, Funahashi T. Importance of adipocytokines in obesity- related diseases. Horm Res 2003; 60 (suppl 3):56-9.
- Reiser R, Sidelman Z. Control of serum cholesterol homeostasis by cholesterol in the Milk of the sucking rat. J Nutr. 1972; 102: 1009-16.
- Wey Y, Wang D, Pagliassotti MJ. Saturated fatty acid-mediated endoplasmic reticulum stress and apoptois are augmented by Trans-10, Cis-12 conjugated linoleic acid in liver cells. Molecular and Cellular Biochem. 2007; 303 (1-2): 105-13.
- Takeda S, Karsenty G. Molecular bases of the sympathetic ragulation of bone mass. Bone. 2008; (42): 837-40.
- Emwonwu CO, Ritichie CS. Nutrition and inflammatory markers. JADA. 2007; 138 (1): 70-3.
- Bastos AA, Falcão CB, Pereira ALA, Pereira AFV, Alves CMC. Obesidade e doença periodontal. Pesq Bras Odontopediatria Clin Integr. 2005; 5 (3): 275-9.
- Faisal-Cury A, Zacchello KP. Osteoporose: prevalência e fatores de risco em mulheres de clínica privada maiores de 49 anos de idade. Acta Ortop Bras 2007; 15 (3): 146-150.
- Zannete E, Stringari FF, Machado F, Marroni BJ, Ng DPK, Canani LH. Avaliação do diagnóstico densitométrico de osteoporose/osteopenia conforme o sítio ósseo. Arq Bras Endocrinol Metab. 2003; 47 (1): 30-6.
- Taguchi A, Ohtsuka M, Tsuda M, Nakamoto T, Kodama J, Inagaki K, Noguchi T, Kudo Y, Suei Y, Tanimoto K. Risk of vertebral osteoporosis in post-menopausal women with alterations of the mandible. Dentomaxillofac Radiol 2007; 36: 143-148.
- Armada L, Nogueira CRR, Neves UL, Souza PS, Detogne JP, Armada-Dias L, Moreira RM, Nascimento-Saba CCA. Mandible analysis in sex steroid-deficient rats. Oral Diseases. 2006; (12): 181-186.
- Korse CM, Bonfer JMG, van Beuden M, Verheijen RHM, Rookus MA. Estradiol and testosterone levels are lower after oophorectomy than after natural menopause. Tumor Markers. 2009; 30 (1): 37-42.
- Costa C A, Alves EG, Gonzalez GPL, Barbosa TBC, Carlos AS, Lima VD, Nascimento R, Moura EG, Nascimento-Saba, CCA. Evaluation of body development, fat mass and lipid profile in rats fed with high-PUFA and -MUFA diets, after neonatal malnutrition. Br J of Nutr. 2009; 101 (11): 1639-44.
- Ikemoto S, Takahashi M, Tsunoda N, Maruyama K, Itakura H, Ezaki O. High- fat diet-induced hyperglycemia and obesity in mice: differential effects of dietary oil. Metabolism 1996; 45 (12): 1539-46.
- Duarte ACGO, Fonseca DF, Manzoni MSJ, Soave CF, Sene-Fiorese M, Dâmaso AR, Cheik NC. High fat diet and secretory capacity of insulin in rats. Rev Nut. 2006; 19 (3): 341-48.
- Nian H, Qin LP, Chen WS, Zhang QY, Zheng HC, Wang Y. Protective effect of steroidal saponins from rhizome of Anemarrhena asphodeloides on ovariectomy-induced bone loss in rats. Acta Pharmacologica Sinica. 2006; 27 (6): 728-734.
- Werkman C, Segnini Senra G, Rocha RF da, Brandão AAH. Comparação do uso terapêutico de Risedronato e Calcarea phosphorica - alopatia versus homeopatia - no reparo ósseo em ratos castrados. Braz. Oral Res. 2006; 20 (3): 196-201.
- Halici Z, Boreckci B, Ozdemir Y, Cadirci E, Suleyman H. Protective effects of amlodipine and lacidipine on ovariectomy-induced bone loss in rats. European Journal of Pharmacology. 2008; (579): 241-45.
- Han, X, Xu Y, Wang GJ, Pei X, Yang R, Li N, Li Y. Effects of cod bone gelatin on metabolism and bone microarchitecture in ovariectomized rats. Bone. 2009; 44 (5): 942-47.
- Griel A, Kria-Etherton PM, Hilpert KF, Zhao G, West SG, Corwin RL. Increased dietary indirectly N-3 fat acids decreases a marker of bone resorption in humans. Nutrition Journal. 2007; 6:2.
- Armada L. Parâmetros mecânicos, físicos e químicos na avaliação de mandíbulas de ratos deficientes em esteróides sexuais. Tese (Doutorado em Fisiopatologia Clínica e Experimental) - IBRAG, Universidade do Estado do Rio de Janeiro, Rio de Janeiro. 2009; 75-81.
- Katsumata T, Nakamura T, Ohnishi H, Sakamura T. intermittent cyclical etidronate treatment maintains the mass, strucuture and mechanical property of bone in ovariectomized rats. J Bone Miner. Res. 1995; 10 (6): 921-931.
- Ikeda S, Tsurukami H, Ito M, Sakai A, Sakata T, Nishida S, Takeda S, Shiraishi A, Nakamura T. Effect of trabecular bone contour on ultimate strength of lumbar vertebra after bilateral ovariectomy in rats. Bone. 2001; 28 (6): 625-633.
- Allip RM, Olivera MI, Bozzini C, Mandalunis P, Bozzini CE. Mandibular bone stiffening and increased bone calcium mass in rats permanently stunted by hypophysetomy. Arch Oral Biol. 2006; 51 (10): 876-882.
- Araujo JA, Silva JHV, Amâncio ALL, Lima CB, Oliveira ERA. Fontes de minerais para poedeiras. Acta veterinária brasílica. 2008; 2 (3): 53-60.
- Callister WD. Ciência e engenharia de materiais; uma introdução. 5. ed. Rio de Janeiro: LTC, 2002. p.100.
|


