Recibido para Arbitraje: 08/10/2015
Aceptado para Publicación: 19/01/2016
El síndrome de boca ardiente es una condición clínica que afecta principalmente a mujeres de mediana edad en el período menopáusico; involucra los tejidos blandos de la cavidad bucal. Los pacientes refieren síntomas de, escozor, ardor, picor, dolor bucal, a nivel de lengua, labios, encías, carrillos, en ausencia de signos clínicos, lo cual se hace difícil de diagnosticar. A pesar de que en la literatura científica esta patología está ampliamente descrita, algunos clínicos desconocen su existencia generando diagnósticos incorrectos, donde el paciente se agota por un manejo ineficaz de la enfermedad, alterando su calidad de vida. La etiología es compleja e incluye una variedad de factores: locales, sistémicos y psicológicos. Algunos factores psicológicos como el estrés, la ansiedad y la depresión, se encuentran entre las posibles causas del síndrome de boca ardiente. En este estudio se analiza la literatura que hace referencia a diversos criterios de clasificación, así como el manejo terapéutico del paciente. El tratamiento de esta patología, normalmente se dirige a aliviar los síntomas; sin embargo, es menester, eliminar todos aquellos factores locales que ayudan a empeorar la sensación de ardor bucal. Las opciones de tratamiento más aceptadas que muestran resultados variables incluyen antidepresivos tricíclicos, benzodiacepinas y los fármacos antipsicóticos; pero, existen otras terapias que se pueden llevar a cabo. Los profesionales de la odontología deben formular criterios sintomáticos y de diagnóstico estandarizados con el fin de identificar estrategias efectivas y confiables para el tratamiento de síndrome de boca ardiente, a través de la investigación multidisciplinaria.
Palabras clave: Síndrome de boca ardiente, dolor bucal, xerostomía, disgeusia, glosodinia.
Burning mouth syndrome is a clinical condition that mainly affects middle-aged women in the menopausal period; it involves the soft tissues of the oral cavity. Patients report symptoms such as stinging, burning, itching, mouth pain at the level of tongue, lips, gums, cheeks, in the absence of clinical signs, which is difficult to diagnose. Although in the literature this pathology is widely described, some clinicians are unaware of its existence generating misdiagnosis, making the patient exhausted by ineffective management of the disease, altering its quality of life. The etiology is complex and includes a variety of factors: local, systemic and psychological. Some psychological factors such as stress, anxiety and depression are among the possible causes of burning mouth syndrome. In this study the literature refers to various classification criteria and therapeutic management of patients is analyzed. The treatment of this disease, usually is directed to the relief of symptoms; however, it is necessary to remove all local factors helping to impair the burning mouth sensation. The most accepted treatment options that show varying results include tricyclic antidepressants, benzodiazepines and antipsychotic drugs; but, there are other therapies that can be carried out. The dental professionals should develop symptomatic and standardized diagnostic criteria, in order to identify effective and reliable strategies for the treatment of burning mouth syndrome through multidisciplinary research.
Key words: Burning mouth syndrome, mouth pain, xerostomia, dysgeusia, glossodynia.
CORRESPONDENCIA: [email protected] - [email protected]
El Síndrome de Boca Ardiente (SBA), descrito ampliamente en la literatura científica, se conoce con signos y síntomas característicos que incluyen sensación de ardor, picor, quemazón, dolor bucal, que puede ser localizado o difuso e involucra con mayor frecuencia la lengua, los labios, los carrillos, el piso de boca y la orofaringe; puede presentarse en forma unilateral y bilateral, sin manifestación de lesiones clínicas significativas, es de etiología no definida sin embargo, al evaluar exhaustivamente la cavidad bucal, el signo que se asocia con mayor frecuencia es la xerostomía, aunque los tejidos bucales blandos y el tejido dental aparezcan sin alteraciones que indiquen procesos inflamatorios infecciosos o alguna otra entidad patológica asociada. Para describir al SBA existe una gran variedad de términos tales como: glosodinia, estomatodinia, glosopirosis, estomatopirosis, disestesia oral y dolor bucal 1,2. Por lo aquí expresado se cataloga al SBA como una entidad idiopática caracterizada por un dolor fantasma que disminuye la calidad de vida de los pacientes que la presentan 3,4. El SBA puede ir acompañado de una alteración del gusto (disgeusia) y de boca seca (xerostomía), esto es subjetivo. Se inicia en forma espontánea, y tiene clara predisposición a manifestarse en mujeres pre y post menopáusicas. El SBA en su forma secundaria puede estar asociado con varias condiciones orgánicas que incluyen: infecciones bucales, candidiasis, líquen plano, alergias, reflujo, drogas, deficiencias de vitaminas y minerales, trastornos psiquiátricos, enfermedades de la tiroides, diabetes mellitus y otros 5,6.
Esta condición fue descrita por primera vez en el siglo XIX, posteriormente, fue caracterizada a inicios del siglo XX por Butlin y Oppenheim como glosodinia 7. En los años posteriores se refieren a la boca ardiente como glosopirosis, estomatodinia, estomatopirosis, disestesia bucal, dolor en la lengua, 8. En el 2004, fue caracterizada como una dolencia distinta, pero, la Sociedad Internacional de Cefaleas, define al SBA como “una sensación de quemazón intrabucal sin causa médica u odontológica que lo identifique”. Los criterios diagnósticos actuales consisten en un dolor en la cavidad bucal, en forma diaria y persistente; la mucosa bucal presenta una apariencia normal, después de realizar chequeos para excluir enfermedades locales o sistémicas 9. Es de etiología multifactorial, donde participan factores locales, sistémicos y psicológicos. Es más frecuente en mujeres alrededor de la perimenopausia, siendo la depresión, ansiedad, enfermedad de Parkinson y enfermedades crónicas que incluyen la enfermedad gastrointestinal y la enfermedad urogenital, son factores de riesgo para su desarrollo 10,11,12.
El SBA es una condición clínica con síntomas incómodos que causan un impacto directo e indirecto en la calidad de vida del paciente, sobrecargando al mismo paciente y al sistema de salud. Pacientes con estas dolencias, consultan día a día a profesionales de la salud que no están preparados para resolverle su problema 13.
Scala y col. 14, propone clasificar al SBA en dos tipos de acuerdo a su clínica: Tipo I SBA idiopático, primario o esencial, donde no existen causas locales o sistémicos que puedan ser identificadas; Tipo II SBA secundario, se debe a causas orgánicas tales como: infecciones bucales, enfermedades autoinmunes de la mucosa bucal (liquen plano), candidiasis, diabetes mellitus, deficiencias vitamínicas y nutricionales, administración de ciertas drogas, alergias, irritación causada por reflujo gastroesofágico 15,16.
Debido a que esta patología bucal, tiene predilección por mujeres menopáusicas y alrededor de la quinta década de vida, es importante resaltar que, según la Organización Mundial de la Salud, la proporción de personas mayores está aumentando rápidamente en todo el mundo 17. Se estima que para el año 2100, la proporción de personas mayores de 60 años será el triple de las que existen actualmente, representando los trastornos neuropsiquiátricos el 6,6% de la discapacidad total de ese grupo etario 17.
El propósito de la presente revisión bibliográfica, fue el análisis detallado de todos los aspectos etiológicos, clínicos, epidemiológicos y variantes de tratamiento para esta rara entidad que se perfila como una de las más frecuentes en un futuro no muy lejano. Se realizó una revisión de la literatura científica nacional e internacional de revistas indexadas y localizadas principalmente, en la base de datos Pubmed.
La epidemiología del SBA ha sido poco descrita en la literatura debido a la variabilidad de criterios para diagnosticarla 18. Pocos estudios aleatorios se han llevado a cabo con una muestra representativa de la población total en las diferentes regiones del planeta, sin embargo, se reporta que el SBA afecta entre un 3.7% y un 18% de la población general 19. En diferentes países del mundo se han llevado a cabo algunos estudios aleatorios con una muestra representativa de la población total. En Estados Unidos sólo se ha ejecutado un estudio sobre la población total, realizado por The National Institute of Dental Research y The National Center for Health Statistics que estiman sobre un total de 1.270.000 adultos sólo el 0,7% manifestó haber experimentado sensación de ardor bucal en forma prolongada; 758.000 de estos adultos eran mujeres y 512.000 hombres, lo cual representa, respectivamente, a un 0.8% y 0.6% de la población total en esa época, mientras estudios realizados en Canadá y Europa indican que la prevalencia alcanza un 4 y un 7% comparativamente 20. Tammiala-Salonen y col. 21, realizaron un estudio en la población adulta de Finlandia reportando una tasa de un 15% con SBA, donde la mitad de los pacientes presentaban lesiones visibles en la mucosa bucal. Otro estudio realizado en 1.000 pacientes suecos registrados en el Servicio de Salud Dental Pública seleccionados al azar; 3,7% de los pacientes, fueron diagnosticados con SBA después de reportar síntomas de ardor en la boca y ser sometidos a nuevos exámenes físicos 22.
Lipton y col.23 reportaron una prevalencia de 0,7% basados sólo en los síntomas reportados por 45.000 familias estadounidenses. Haberland y col. 24 atendieron en su clínica a nuevos pacientes y observaron que el 10% de ellos, fueron diagnosticados con SBA. Un estudio retrospectivo en 3.000 pacientes brasileños referidos para Servicio de Patología Bucal, notificó una prevalencia de aproximadamente 1% 25. La variabilidad de estas tasas se atribuye a la disparidad en la edad de los grupos de la población examinada, debido a que la prevalencia del SBA aumenta drásticamente con la edad, así como la falta de criterios diagnósticos aceptados universalmente para el SBA. Se necesitan más estudios a realizar con criterios satisfactorios para determinar la prevalencia real del SBA, estos datos demuestran que la enfermedad es una condición clínica importante que a menudo puede encontrarse en la práctica clínica.
El SBA afecta principalmente a mujeres, en una proporción 7:1 con respecto a los hombres; también afecta a adultos jóvenes entre los 30 y 40 años 25,21,23,24. Suzuki y col. 23, realizaron un estudio en Japón, con 2.599 pacientes reportando que obtuvieron una prevalencia de 9.3% en hombres y 10.8% en mujeres, destacándose la predilección del SBA en el género femenino. En la mayoría de los casos, el SBA se manifiesta en mujeres en edad menopáusica, pre y post, en una relación 33:1 con respecto a los hombres, con una prevalencia del 10% al 18%.La etiología del SBA es imprecisa, posiblemente es de origen multifactorial, los diferentes criterios a veces se confunden con el dolor buco facial 26,27; sin embargo, dentro de los factores etiológicos revisados en la literatura se encuentran investigaciones que relacionan los síntomas del SBA y la existencia de factores somáticos que incluyen: hiposalivación, hábitos parafuncionales, diabetes mellitus, deficiencias nutricionales y vitamínicas, desórdenes hormonales; causas neuropsiquiátricas, endocrinas, inmunológicas, infecciosas, iatrogénicas, todas agrupados en factores locales, sistémicos y psicológicos, así como los efectos adversos de algunos medicamentos 28,29,30.
El SBA afecta más comúnmente a las mujeres en edad perimenopáusicas. Es un hallazgo que se ha atribuido a la resequedad de las mucosas, como resultado de la reducción de los niveles de estrógeno y progesterona relacionados con la edad y un aumento de la frecuencia de los trastornos psicológicos en las mujeres de mediana y avanzada edad 31. Woda y col. 32, sugieren que la disminución de las hormonas esteroideas durante la menopausia lleva a una reducción concomitante de esteroides neuroactivos, lo que conduce a la degeneración de fibras nerviosas pequeñas en las áreas de la mucosa y del cerebro, involucrados con sensaciones somáticas bucales. Estos cambios pueden llegar a ser irreversibles, lo que resulta en un ardor intenso con síntomas asociados. Gao y col. 33, demostraron que los pacientes en etapa pre y posmenopáusica que presentan SBA pueden tener menos niveles de estradiol y aumento de los niveles de la hormona folículo estimulante en comparación con pacientes sanos. Alteraciones en el balance hormonal de la dehidroepiandrosterona también puede estar relacionadas con el SBA 30.
Existen evidencias de etiología inmunológica; reacciones alérgicas de antígenos provenientes de la dieta han sido demostradas en pacientes con SBA. Entre éstos se incluyen el ácido ascórbico, la canela, el ácido nicotínico, el propilenglicol y el ácido benzoico 34,35. Otros alérgenos identificados con pruebas cutáneas son metales dentales como zinc, cobalto, mercurio, oro, paladio 36. El lauril sulfato de sodio, es un componente de carácter detergente, presente en la mayoría de las pastas dentales, conocido por causar resequedad en la boca, por lo que puede estar implicado en el desarrollo del SBA 37. Otras enfermedades autoinmunes del tejido conjuntivo, como el síndrome de Sjögren y lupus eritematoso también se asocian con el SBA 38.
El SBA también se ha relacionado con deficiencias nutricionales y vitamínicas tales como deficiencias del complejo B (B1, B2, B6 y B12) y del ácido fólico 39. La deficiencia de zinc también es una posible causa de la enfermedad, debido a que pacientes que fueron sometidos a tratamientos de reemplazo de zinc, manifestaron mejoría de los síntomas del SBA 40.
Los pacientes con SBA, poseen alta prevalencia de especies de Cándida como Enterobacter y Klebsiella 41,42. Esta manifestación puede estar relacionada con la xerostomía y revestimientos de prótesis dentales; un posible origen infeccioso del SBA es sugerido por los informes de remisión después del tratamiento antimicótico bucal 43.
El SBA vinculado a las drogas es reportado en la literatura. Los inhibidores de la enzima convertidora de angiotensina y los bloqueadores de los receptores de angiotensina, pueden desencadenar el desarrollo del SBA, probablemente debido a mayores niveles de calicreína en la saliva de los pacientes con la enfermedad, que produce inflamación de la cavidad bucal 44,45,46. La nevirapina y efavirenz son causa del SBA por mecanismos desconocidos 47,48. En pacientes con la enfermedad de Parkinson, la levodopa puede tener un papel en el desarrollo del SBA 49.
Un estudio realizado por Lauria y col. 28, explica que la densidad de las fibras nerviosas epiteliales fue significativamente más baja que las mostradas por el grupo control, sobre la base de la duración de los síntomas. Ratifican que las fibras nerviosas epiteliales y subpapilares del nervio trigémino mostraron cambios morfológicos que se manifestaron con una degeneración axonal. Sena 29, relaciona la etiología del SBA con cambios polimórficos en el gen de la serotonina que se traduce en la expresión de la interleucina 1 beta (citosina proinflamatoria relacionada con la modulación del dolor) en pacientes con SBA diagnosticados. Jääskeläine 50, realizó una investigación donde sugiere la necesidad de realizar estudios sistemáticos para explicar con evidencia clínica y científica los factores causales de la neuropatía de las fibras periféricas pequeñas, lo que no se ha podido determinar. También propone que las alteraciones psicológicas podrían ser un factor desencadenante del SBA o está asociada al curso de la enfermedad.
Los factores psicopatológicos han sido mencionados a lo largo de las diferentes investigaciones y están involucrados en la etiología del SBA, sobre todo en aquellos pacientes que manifiestan efectos adversos en sus vidas, donde la inestabilidad emocional, la ansiedad y la depresión son evidentes en el 60% de los pacientes estudiados 51. Ciertas investigaciones sugieren que la ansiedad, la depresión, la ausencia de una personalidad sólida y satisfactoria suelen estar en estrecha relación con los pacientes diagnosticados con el SBA; para Palacios Sánchez y col. 52, existe una asociación entre los cambios en la vida de los pacientes y el establecimiento del SBA, pero, aún no está claro si los desórdenes de personalidad observados en estos pacientes son una causa o una consecuencia del SBA 53.
Diagnosticar el SBA, constituye un gran reto, debido a que los criterios de diagnóstico no están definidos universalmente y además, son confusos y variables 13.
Scala y col. 14, proponen algunos criterios primordiales: 1. Sensación de ardor en la mucosa bucal en forma diaria y constante; 2. Sensación de quemazón por lo menos de 4 a 6 meses; 3. Intensidad del dolor, constante o puede aumentar durante el día; 4. Dolor presente sin exacerbación, o puede mejorar durante las comidas e ingesta de líquidos; y 5. No presenta interferencia durante el sueño. Como criterios adicionales los autores manifiestan: 1. disgeusia (alteración del gusto con sensación metálica), xerostomía (sensación de resequedad de la boca); 2. alteraciones sensoriales; y 3. cambios psicopatológicos o de estado de ánimo.
El clínico, debe realizar una historia clínica exhaustiva, preguntando al paciente sobre los factores asociados al SBA, debe indagar sobre el estado de ánimo, en caso de que haya ocurrido algún cambio, hábitos dietéticos, deficiencias nutricionales y vitamínicas, cambios en medicamentos. El examen físico de la cavidad bucal debe ser profundo y detallado como: revisar los procedimientos dentales, uso de prótesis dentales, observación de mucosa bucal y encías. Se manda a realizar exámenes de laboratorio como: hematología completa, glucosa en sangre, marcadores autoinmunes, estrógeno y progesterona, pruebas alérgicas, medición del flujo salival 14,54.
Ante el interrogatorio, el paciente define su dolor como que le quema la boca, presenta, hormigueo y adormecimiento, involucrando la lengua, los labios, el paladar duro, acompañado de alteraciones en el flujo salival, el gusto pero, la mucosa bucal no presenta signos aparentes de la enfermedad, no evidenciando cambios estructurales ni lesiones locales 25,18,51,30,52. Los episodios del SBA son espontáneos y los síntomas varían de grado de severidad; algunos pacientes se quejan de dolor moderado, otros presentan un dolor insoportable, a pesar de no presentar cambios orgánicos y no representar un riesgo para la vida de los pacientes. Su calidad de vida se ve afectada por los síntomas de la enfermedad 26.
El dolor suele presentarse en forma bilateral, aunque ocasionalmente puede mostrarse unilateral. Al inicio suele ser espontáneo, sin embargo en muchas ocasiones puede empezar después de un hecho determinado que el paciente considera desencadenante, tal como la administración de un nuevo medicamento o un tratamiento odontológico. La molestia suele variar, persiste a lo largo del día, no paroxística, se incrementa gradualmente hacia la tarde-noche y no interfiere con el sueño 28.
En considerables ocasiones, el paciente muestra un perfil psicopatológico alterado, con irritabilidad, ansiedad, depresión. El diagnóstico del SBA primario sigue siendo un reto para el odontólogo clínico, pues no existen criterios suficientemente objetivos y universalmente aceptados.
El esquema de manejo protocolar del SBA según la evidencia descrita en la literatura, incluye la interrelación multidisciplinaria debido a la etiología multifactorial del mismo, lo cual exige la identificación de los síntomas descritos y obliga a establecer la terapéutica sugerida, ésto hace imperioso definir si la entidad patológica obedece a un efecto secundario debido a la existencia de desórdenes hormonales, efecto medicamentoso, cambio de fármaco, deficiencias vitamínicas o nutricionales, alergias, hábitos, entre los más relevantes. Si los síntomas no obedecen a ninguno de estos factores, el síndrome estará catalogado como primario o idiopático y el tratamiento incluirá el suministro de fármacos tópicos (clonazepam) o sistémicos (ácido alfa (α) lipoico, inhibidores selectivos de serotonina (paroxetina, sertralina, amilsuprida) o la combinación de ellos con psicoterapia (Figura 1) 55. La literatura considerada no establece una dosificación eficaz y consistente para controlar farmacológicamente la enfermedad y de igual manera, el tiempo de administración de los medicamentos estará sujeto a la evolución del paciente y a la remisión de los síntomas 18,51,52,26.
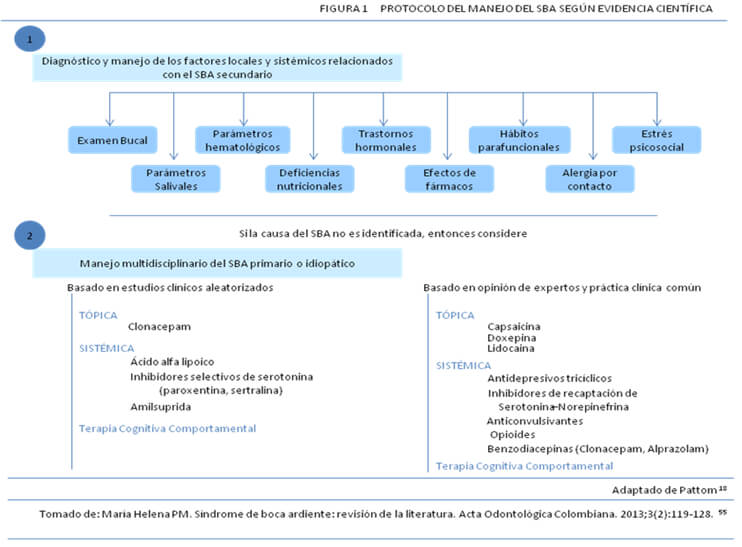
Femiano y col. 26, exaltaron la administración de ácido α lipóico en dosis de 600 miligramos (mg) (mg/día) y encontraron una mejoría en los pacientes a los dos meses de administrarlo. El ácido α-lipóico es capaz de eliminar los radicales libres, es una coenzima que actúa en la producción de energía, y como antioxidante-neuroprotector. Sin embargo, en otros estudios no se han obtenido buenos resultados con este tratamiento 56,57.
Femiano y Scully 58., estudiaron su efecto en pacientes con SBA y obtuvieron buenos resultados respecto a los pacientes que recibieron placebo. López-D'Alessandro y Escovich 59., mostraron mejores resultados combinando el ácido α lipóico (600 mg/día) y ácido γ-aminobutírico (300 mg/día), un agente anticonvulsionante usado en el tratamiento de la neuropatía periférica, con una mejoría del 70% en los síntomas asociados.
Cavalcanti y Da Silveira 57, utilizaron ácido α lipóico 600 mg/día en 19 pacientes con SBA y el 89,9% de los pacientes, lograron mejoría de los síntomas, pero no ocurrió diferencia significativa entre los grupos. Carbone y col. 60, compararon 18 pacientes que habían sido tratados con (800 mg/día) de ácido α lipóico, 14 pacientes tratados con (400 mg/día) de ácido α lipóico y vitaminas (dos veces al día), y 20 pacientes tratados con placebo; no observaron mejoría significativa entre los grupos.
López-Jornet y col.56 en un ensayo clínico aleatorizado, compararon ácido α lipóico (400 mg/día) y placebo y no hallaron diferencias significativas entre los grupos. Un estudio aleatorizado, doble ciego, controlado con placebo, demostró que el uso de la gabapentina (300 mg/día) sola, o asociada con ácido α lipóico (600 mg/día), fue beneficioso en la disminución de los síntomas en un 50% a 70% en pacientes con SBA, cuando se compara con placebo apenas 15% 59.El clonazepam es una benzodiacepina que tiene un efecto inhibitorio sobre el sistema nervioso central y es usado ampliamente como un agente ansiolítico. Gremeau-Richard y col. 61, estudiaron 48 pacientes con SBA, a 24 pacientes se les administró clonazepam tópico, los 24 pacientes remanentes, se les suministró placebo, tratados durante dos semanas. Los resultados mostraron 72% de mejoría con efectos secundarios de xerostomía, somnolencia y ardor.
Rodríguez de Rivera Campillo y col. 62, realizaron un estudio para evaluar a 33 pacientes que recibieron clonazepam 0,5 mg/día utilizado como enjuague, durante 3 minutos y 33 tabletas de placebo utilizadas de la misma manera, con un seguimiento de 1 a 6 meses. Aproximadamente el 69% de ellos que utilizaron clonazepam mostraron mejoría en los síntomas, y sólo el 12% de los controles obtuvieron una respuesta positiva. Sin embargo, con respecto a la curación de los síntomas, el resultado no fue significativo en ninguno de los grupos.
Amos y col. 63, realizaron un estudio combinando clonazepam en forma tópica y sistémica en 36 pacientes. Tópica: (tabletas de 0,5 mg tres veces al día) y sistémica: (ingeriendo pastillas después de unos pocos minutos). Después de 6 meses de tratamiento, el 80% logró una mejoría significativa en cuanto al dolor y el 33% tenía una resolución completa de los síntomas sin embargo, existe la necesidad de realizar más estudios aleatorizados para poder evaluar mejor los efectos de esta asociación.
Heckmann y col.64, en un estudio de casos y controles, evaluaron a 20 pacientes con SBA durante 9 semanas y los clasificaron en dos grupos. El primer grupo consta de 10 pacientes al que le suministraron clonazepam de 0,5 mg/día y al otro grupo se le suministró un placebo. No hubo cambios fisiológicos significativos ni mejoras en las pruebas gustativas ni en el flujo salival en ambos grupos. No obstante, el dolor se redujo significativamente en el grupo de prueba, y el estudio concluyó que a bajas dosis de clonazepam, este fue más eficaz en individuos jóvenes con menos tiempo de la enfermedad.
Ko y col. 65, evaluaron 100 pacientes con SBA y explicó que el clonazepam tenía un mayor efecto en pacientes con sustancial flujo salival, en pacientes sintomáticos severos, y en pacientes que no estaban usando drogas psicotrópicas.
El clonazepam ha sido la terapia con más aceptación en cuanto a eficacia por la mejoría de las molestias en pacientes con SBA 66. Es utilizado vía oral en dosis de 0,75 mg al acostarse y 0,25 mg después de comer, pero, en su mayoría, se administra como medicación tópica en forma de solución 0,5 mg/5 mL para enjuagues bucales de 5 min de 2 a 4 veces al día, con una respuesta satisfactoria del 61%, y es bien tolerado y relativamente seguro. Otra forma de administración son los comprimidos, chupados hasta deshacerse en boca, pero sin tragarse la saliva. Esta benzodiacepina tiene una acción sobre los receptores del ácido γ-aminobutírico (GABA) periféricos. Inhibe la transmisión dolorosa y, en casos de desaferencia (interrupción de la transmisión de los impulsos nerviosos desde una parte del sistema nervioso a otra), suprime la hiperactividad neuronal.
El clonazepam no siempre es eficaz, depende del nivel de la alteración neuropática. Se han descrito unos factores de la eficacia del clonazepam, que serían la gravedad de los síntomas iniciales y la presencia de molestias acompañantes, como la xerostomía y la disgeusia 63.
A pesar de los posibles efectos secundarios que pueden ocurrir a dosis bajas, clonazepam ha mostrado resultados prometedores para el alivio de los síntomas. Además del clonazepam, se han administrado como segunda opción anticonvulsionantes tales como la gabapentina y la lamotrigina 67.
La capsaicina es el principal componente de la cayena, de la guindilla y de otros pimientos picantes. Todas estas plantas son solanáceas siendo la Capsicum annum (Guindilla de las Indias) la más importante con 1.5% de una oleorresina compuesta principalmente por capsaicina. Los preparados a base de capsaicina se pueden utilizar sin récipe médico para el tratamiento de dolores musculares y articulares 68.
La capsaicina depleciona (disminuye) y previene la acumulación de la sustancia P en las neuronas sensoriales periféricas. La sustancia P es un péptido de 11 aminoácidos que se cree es el mediador primario del dolor en el sistema nervioso periférico. El péptido P es liberado en las articulaciones donde activa otros mediadores inflamatorios implicados en el desarrollo de la artritis reumatoidea. Al deplecionar la sustancia P de las terminaciones nerviosas en la piel y las articulaciones la capsaicina bloquea la transmisión del impulso doloroso. Cuando se interrumpe un tratamiento con capsaicina, la sustancia P se acumula nuevamente retornando a la normalidad la sensibilidad nerviosa 68.
La capsaicina, un componente de pimientos, puede unirse TRPV1 (Transient Receptor Potential Vallinoid 1) un potente receptor de calcio. Las respuestas neuronales inactivas están vinculadas al calor por lo tanto, la exposición prolongada a la capsaicina puede agotar el TRPV1 en los tejidos periféricos, contribuyendo a la desensibilización a largo plazo de los nociceptores periféricos y consecuentemente una disminución del ardor 68.
Para poder controlar la molestia principal de ardor, se han administrado diferentes sustancias por vía tópica, como la capsaicina en dosis de 0,025%-0,075%, de dos a tres veces al día, que actúa en forma competitiva con el Receptor Valinoide 1 (VR1) inhibiendo la síntesis y transporte de la sustancia P, aunque tiene el inconveniente de su intolerancia clínica en un 30% de los pacientes 68,69.
Petruzzi y col. 68, estudiaron a 50 pacientes con SBA; a 25 de ellos, le suministraron capsaicina sistémica al (0,25%) y los otros 25, le proporcionaron un placebo durante 30 días. Los síntomas mejoraron en el 80% de los pacientes que utilizaron la capsaicina sin embargo, el dolor epigástrico ha sido reportado como un efecto secundario importante.
Marino y col. 70, en un estudio compararon: capsaicina tópica (250 mg/50 mL), ácido α lipoico 800 mg/día, lisozima lactoperoxidasa, y placebo en 56 pacientes con SBA, los grupos fueron divididos en partes iguales. Los síntomas mejoraron en el 76% de pacientes que usaron capsaicina tópica, 57% en pacientes que utilizaron ácido α lipoico, 57% de los que emplearon lisozima lactoperoxidasa y 79% de los que emplearon placebo. El estudio reveló grandes resultados sin efectos secundarios reportados, pero, la tasa de placebo fue cercana a los fármacos probados.
La mayoría de las terapias expuestas han descrito mejoría en los estudios realizados frente al grupo control, en ocasiones describen la desaparición completa de las molestias, por otra parte, describen mejoría de los síntomas con uso del placebo.
La gabapentina es un anticonvulsionante cuya estructura química está constituida por una molécula de ácido gamma-aminobutírico (GABA) unida covalentemente a un anillo de ciclohexano lipofílico. Este fármaco fue creado para actuar como un agonista del GABA, neurotransmisor inhibitorio de la actividad esencial, puesto que se transfiere fácilmente al sistema nervioso central (SNC) por tener alta solubilidad en lípidos. El mecanismo de acción de la gabapentina es desconocido, ya que actúa aumentando la descarga promovida de GABA, sin embargo, no reduce constantemente los potenciales de acción o el efecto de la corriente del canal de calcio 71,72.
La Cátedra de Clínica Estomatológica II de la Facultad de Odontología del Rosario en Argentina, realizó un ensayo clínico aleatorizado, doble ciego y con placebo controlado en 120 pacientes con SBA. Los 120 pacientes fueron divididos en forma aleatoria en 6 grupos de 20 cada uno. A su vez, le asignaron un orden numérico a cada grupo (1, 2, 3, 4, 5 y 6). Por otro lado, se determinaron seis ciclos de tratamientos: (ciclos A, B, C, D, E y F), de modo que el ciclo A (n = 20) corresponden a 600 mg/día de AAL, el ciclo B (n = 20) 300 m/día de GABA, el ciclo C (n = 20) a la combinación de ambos fármacos y los ciclos D (n = 20), E (n = 20) y F (n = 20) fueron 100 mg/día de almidón y la celulosa (Placebo). Se obtuvieron cuatro categorías para el análisis de los resultados: Categoría 1: con los cambios negativos (empeoramiento), Categoría 2: sin cambios; Categoría 3: con los cambios positivos (mejoras) y Categoría 4: con una recuperación total. Al observar los pacientes que recibieron AAL, se encontró que 20.9 (45%) de ellos no presentan cambios mientras que, el restante 11/20 (55%) tuvieron cambios positivos o recuperación total. Entre los pacientes tratados con GABA, 10/20 (50%) se mantuvo sin cambios mientras que el resto manifiesta disminución del ardor o quemazón. Entre los que recibieron la combinación de ambos fármacos, solamente 6/20 (30%) se mantuvo sin cambios mientras que 14/20 (70%) obtuvieron cambios positivos. En el grupo de pacientes que recibieron placebo, 51/60 (85%) se mantuvo sin cambios o empeoraron, mientras que 9/60 (15%) consiguieron cambios positivos 71.
Nuevos fármacos utilizados para las terapias del SBA han sido los antidepresivos, con resultados diferentes pero bastante aceptables. Se han suministrado antidepresivos tipo sertralina, duloxetina, amitriptilina y paroxetina 73,74, de todos ellos, la paroxetina ha dado mejores resultados, si bien, en algunos casos se han descrito efectos secundarios 75.
La paroxetina es un inhibidor de la recaptación de serotonina (ISRS) con actividad antidepresiva y ansiolítica, disponible en formulaciones de liberación inmediata y liberación controlada (CR) 76.
Yamazaki y col. 77, realizaron un estudio piloto para evaluar la efectividad y la tolerabilidad de la paroxentina para el tratamiento de pacientes con SBA. Realizaron un estudio prospectivo, no comparativo, abierto, con una duración de 12 semanas, a 71 pacientes con SBA primario o idiopático, para tomar una dosis inicial de (10 o 20 mg/día) de paroxetina. La dosis se incrementó a un máximo de 30 mg/día. De estos pacientes, 52 estaban disponibles para examinar la eficacia del tratamiento en este estudio es decir, 80,8% (42/52). Los pacientes que manifestaron una remisión total del dolor fue 70,4% (19/27). Los efectos de la paroxetina fueron dependientes de la dosis. La ocurrencia de reacciones adversas en la dosis diaria inicial de 10 mg fue de (41%) significativamente menor a la dosis de 20 mg (76%). El 80% de los pacientes con SBA experimentaron reducción del dolor en 12 semanas de tratamiento de paroxetina con efectos secundarios transitorios menores. Estos resultados sugieren que la paroxetina puede ser útil en el tratamiento de pacientes con SBA.
Los autores citados anteriormente, realizaron también un estudio piloto dependiente de la dosis sobre el efecto de paroxetina para el tratamiento de 52 pacientes con SBA. Durante 12 semanas, los pacientes recibieron paroxetina de 10 a 30 mg/día (dosis ajustada cada 15 días de acuerdo a los síntomas del paciente y 10 mg cada vez) y domperidona para evitar efectos secundarios de náuseas, durante las primeras 2 semanas. Después de 12 semanas de tratamiento, cerca del 80% de los pacientes, obtuvo una mejoría respecto al dolor y hubo pocos efectos secundarios. El autor propone comenzar estos tratamientos con 10 mg/día e ir aumentando 10 mg cada 2 semanas hasta alcanzar un máximo de 30 mg/día si la dosis fuera insuficiente; no obstante, en este estudio no hubo comparación con el placebo 77.
La catuama es un producto a base de un conjunto de hierbas, hecho en Brasil durante más de 20 años. Dicho producto es conocido por sus efectos revitalizantes y disminuye la debilidad física y mental. Dicho producto, consiste en una mezcla de cuatro plantas medicinales tales como: Paullinia cupana (guarana), Trichilia catigua (catuaba), Zingiber officinale (ginger), y Ptychopetalum olacoides (Muira Pauma). La combinación de estos cuatro componentes mostró propiedades antinociceptivo, antidepresivo, y vasorrelajante con la participación de los sistemas dopaminérgicos y serotoninérgicos 78.
Spanemberg y col. 78, realizaron un estudio a 72 pacientes con SBA, en forma aleatorizada, doble ciego y controlado. Los pacientes se dividieron en un grupo experimental (n = 38) y un grupo control (n = 34). Los pacientes fueron adiestrados a que debían tomar dos cápsulas al día de Catuama durante 8 semanas. Concluido el tratamiento, los investigadores observaron que los síntomas se redujeron en un 52,4% en el grupo experimental y 24,2% en el grupo control, conservándose estos resultados en forma estable hasta el final de las 12 semanas. Un paciente se quejó de somnolencia y aumento de peso y otro paciente, se quejó de insomnio.
El Aloe vera conocido como sábila, aloe de Barbados o aloe de Curazao, es una planta de la familia Xanthorrhoeaceae, subfamilia Asphodeloideae. Actualmente, hay más de 250 diversas variedades reconocidas de Aloe, de las cuales, solamente tres o cuatro tienen características curativas o medicinales significativas. La más potente de estas, rica en vitaminas, minerales, aminoácidos y enzimas es el Aloe vera 79.
La aplicación tópica del Aloe vera (AV) combinada con un protector lingual, puede eliminar parafunciones, proteger la mucosa bucal de traumatismos repetitivos y aliviar los síntomas del SBA. López-Jonet realizaron un estudio, utilizando aplicación tópica de Aloe vera tres veces al día combinado con un protector lingual 79. El estudio de casos y controles, doble ciego, aleatorizado, tuvo una duración de 12 semanas. Los pacientes con SBA; fueron divididos en tres grupos: grupo I los que utilizan solamente protector lingual; el grupo II los pacientes que utilizan AV y un protector lingual; el grupo III utilizan un protector lingual y un placebo. En términos de ansiedad, los pacientes fueron homogéneos, y se observó en todos los grupos, una mejoría en la puntuación en la prueba de la escala visual analógica (EVA) para la valoración de la intensidad del dolor, pero no hubo diferencias significativas evidentes entre los grupos en la categoría de ansiedad y calidad de vida, lo que demanda más estudios con este tratamiento durante períodos más largos.
La acupuntura es una técnica curativa muy antigua utilizada en la China durante siglos para el tratamiento y la prevención de enfermedades. Por lo demás, esta técnica se está utilizando cada vez más en los países occidentales como método alternativo en el tratamiento del dolor 80.
Yan Z y col. 81, realizaron una revisión sistemática de artículos chinos que compararon el tratamiento del SBA a través de la técnica de la acupuntura, seleccionando nueve estudios más relevantes. En siete de los ensayos en esta técnica de acupuntura realizados, se demostró que hubo una mejoría significativa de los síntomas en los pacientes con SBA, en comparación con el grupo control. Sin embargo, todos los estudios realizados en la China, sólo han sido publicados en revistas locales y su metodología es cuestionable.
La terapia cognitiva o psicoterapia, está surgiendo cada vez más en la literatura. Esta terapia, se ha mostrado cada vez más eficaz en el manejo de los pacientes con SBA, bajando el nivel de ansiedad y mejorando sus molestias. Bergdahl y col. 82, realizaron un estudio donde demostraron una mejoría en los síntomas de pacientes con SBA que recibieron solamente tratamiento de terapia cognitiva, mostrándose una diferencia significativa con el grupo placebo.
Femiano y col. 26, estudiaron un grupo sólo con terapia cognitiva (2 h/semanales, durante 2 meses), otro grupo le suministraron sólo AAL (600 mg/día durante 2 meses), a otro grupo le practicaron la combinación de los dos anteriores (terapia cognitiva y AAL), y el grupo control lo constituyó el placebo. El resultado más significativo se observó en el grupo que utilizó la terapia cognitiva con el AAL, con resolución completa en el 53% y una cierta mejoría en el 90%.
Un hábito parafuncional puede contribuir al dolor en la cavidad bucal, por lo tanto, modificar esos hábitos parafuncionales puede provocar alivio en los síntomas. Los protectores linguales utilizados por 25 minutos tres veces al día demostraron mejorar significativamente la escala del dolor. López-Jornet y col. 83, Realizaron un estudio prospectivo, aleatorizados de la eficacia del protector lingual en pacientes con SBA. Dividieron 50 pacientes en dos grupos: Grupo A (n = 25) utiliza sólo técnicas de autocontrol y Grupo B (n = 25) utiliza el autocontrol más el protector lingual, que consiste en una cubierta de polietileno transparente, de un sólo tamaño, utilizado durante 15 minutos, tres veces al día, durante 2 meses. Los mejores resultados se obtuvieron en el segundo grupo con una diferencia estadísticamente significativa. Sin embargo, el estudio se realizó con un pequeño número de pacientes y con un seguimiento insuficiente.
El Hypericum Perforatum también conocido como hipérico, hipericón, corazoncillo o hierba de San Juan, es la especie más abundante de la familia de las gutíferas (Guttiferae) o hipericáceas (Hypericaceae). El Hipérico es un medicamento a base de hierbas que se utiliza para aliviar síntomas de depresión leve a moderada y síntomas asociados tales como ansiedad, tensión muscular generalizada y dolor. Sardella y col. 84, realizó un estudio aleatorizado, doble ciego, placebo-controlado con el extracto de Hypericum perforatum en pacientes con SBA, conducido en un centro único. Estudiaron 43 pacientes con SBA, divididos en dos grupos. El primer grupo, constituyó el grupo experimental que utilizó extracto de Hypericum perforatum (hiperforina 0,31% y 3,0%, 900 mg/día) y el segundo grupo constituyó el grupo control, que utilizó un placebo tres veces al día durante 12 semanas. Después de 3 meses de tratamiento, no hubo mejoría significativa de los síntomas. El principal efecto secundario que observaron fue dolor de cabeza.
El SBA sigue siendo una condición clínica retadora no solo para diagnosticarlo, sino también para tratarlo, siendo necesario discriminar la parte idiopática de la sintomática en cuanto a diagnóstico se refiere, para luego determinar las estrategias de tratamiento para los pacientes con esta dolencia.
La evidencia sugiere que el SBA es una entidad multifactorial con bases fisiológicas y psicológicas, cuyo desarrollo y presentación clínica afectan negativamente la calidad de vida de los pacientes. Involucra una variedad de síntomas que podrían ocasionar un diagnóstico distorsionado y una terapéutica inadecuada.
La etiología del SBA es compleja y multifactorial, por lo que necesita la colaboración de los diversos especialistas. Es necesario realizar nuevos ensayos bajo estrictos protocolos, para aportar nuevas perspectivas para el uso de varias modalidades terapéuticas en el SBA.
Es importante informar a los pacientes acerca de la naturaleza de esta enfermedad para el mejor entendimiento de su patología. Además de la principal fuente de información que la constituye el clínico, contamos con otras fuentes de información como las páginas web con información acreditada y dirigida a los pacientes con SBA.