Recibido para arbitraje: 29/11/2016
Aprobado para su publicación: 03/07/2017
Antecedentes: Las alteraciones periodontales inflamatorias se incluyen dentro de las patologías crónicas de origen multifactorial, donde la capacidad reducida del hospedero y la patogenicidad de los microorganismos trae como resultado la aparición de signos, que se expresan desde una discreta inflamación gingival, hasta la pérdida de hueso alveolar. El tratamiento inicial es la terapia periodontal no quirúrgica pero cuando es necesaria la fase quirúrgica el antiséptico de elección es la clorhexidina y aunque su eficacia está comprobada, posee efectos secundarios que aunque son temporales como la pigmentación, son indeseables cuando se este medicamento se utiliza por tiempos prolongados. Por otra parte, la terapia antihomotóxica ha mostrado resultados favorables en el manejo de enfermedades crónicas, infecciosas y procesos inflamatorios, sin mostrar efectos secundarios. Objetivo: Evaluar el efecto bactericida de un medicamento antihomotóxico Traumeel S® en cepas de Fusobacterium nucleatum. Metodología: Estudio experimental In Vitro donde se analizan 36 micro diluciones, 30 con Traumeel S®, 3 controles (+) con Clorhexidina y 3 controles (-) con Agua destilada desionizada, que contienen cepas de Fusobacterium nucleatum. Para verificar el crecimiento bacteriano se utilizó la escala de McFarland. Resultados: Se encontró inhibición en el crecimiento bacteriano de Fusobacterium nucleatum, a una concentración mínima inhibitoria de 50% y efecto bactericida a una concentración mínima de 99.2% de Traumeel S®, Conclusiones: El Traumeel S® tiene efecto bactericida in vitro sobre cepas de Fusobacterium nucleatum.
Palabras clave: Periodoncia, agentes bactericidas, Clorhexidina, Fusobacterium nucleatum.
Background: Inflammatory periodontal changes are included within the chronic pathologies of multifactorial origin, where the reduced capacity of the host and the pathogenicity of the microorganisms results in the appearance of signs, which are expressed from a discrete gingival inflammation, until the loss of Alveolar bone. The indicated treatment is periodontal therapy with scaling and root planning, but when surgical therapy is necessary, it should be accompanied at postsurgical level by chlorhexidine, the first-choice antiseptic, whose its effectiveness has been proven but it has side effects and undesirable as pigmentation, when this Medicine is used for prolonged times. Objective: To evaluate the bactericidal effectiveness of Traumeel S® in Fusobacterium nucleatum strains. Methodology: In Vitro experimental study where 36 microdilutions were analyzed, 30 with Traumeel S®, 3 controls (+) with Chlorhexidine and 3 controls (+) with deionized distilled water containing strains of Fusobacterium Nucleatum and to verify bacterial growth was used The McFarland index. Results: Inhibition of the bacterial growth of Fusobacterium nucleatum at a minimum inhibitory concentration of 50% and bactericidal effect at a minimum concentration of 99.2% of Traumeel S®. Conclusions: Traumeel S® has bactericidal effect in vitro on Fusobacterium nucleatum strains.
Key words: Periodontics, bactericidal agents, Chlorhexidine, Fusobacterium nucleatum.
Dirección de contacto: [email protected]
Las enfermedades periodontales son patologías orales crónicas que se presentan como una inflamación de los tejidos especializados que rodean el diente, con una formación de bolsas periodontales que pueden llevar a la pérdida progresiva del hueso de soporte y de la inserción de tejido conectivo.1 A través de tiempo se ha acumulado una gran cantidad de evidencias acerca de la etiología de la periodontitis. Se han asociado algunos microorganismos denominados patógenos periodontales, relacionados con el inicio y la progresión de la enfermedad. Aunque se han reconocido más de 300 especies aisladas en las bolsas periodontales, tan solo un pequeño porcentaje se consideran etiológicamente importante. Una de las especies más comunes es Fusobacterium nucleatum. Su poder patógeno está asociado con la presencia de fimbrias, producción de factores solubles inhibidores de la quimiotaxis de los polimorfonucleares y a la elaboración de metabolitos que se comportan como compuestos tóxicos tisulares.2
Existen muchos factores de riesgo que desencadenan la enfermedad periodontal, como por ejemplo los malos hábitos de higiene oral, una dieta inadecuada, el consumo crónico de alcohol o tabaco y las condiciones socioeconómicas del individuo que repercuten directamente sobre la oportunidad de acceder a los servicios de salud, para poder tener un adecuado tratamiento. 3 La terapia periodontal es el tratamiento indicado, que se complementa con terapia antimicrobiana con el uso de soluciones antisépticas, siendo el medicamento más usado la clorhexidina, considerada el "Gold Standard” para el control químico de la placa bacteriana, porque tiene amplio espectro; pero el uso prolongado de esta sustancia provoca pigmentaciones en lengua y dientes, además de tener sabor desagradable. 4 Esto sumado a que en la actualidad los pacientes buscan tratamientos alternativos que disminuyan el potencial químico y los efectos adversos, pero que a la vez mejoren su condición.
Hoy en día una forma diferente de abordar al paciente y su enfermedad es la homotoxicología, que es una terapia descrita inicialmente por el médico Hans-Heinrich Reckeweg, como fundamento científico de la medicina antihomotóxica. Esta técnica ha sido estudiada recientemente por médicos investigadores hasta proponerla como una alternativa válida de la medicina moderna. El fundamento principal de la homotoxicología se basa en la reacción del cuerpo ante la presencia de homotoxinas perjudiciales, algunas endógenas producidas por el mismo organismo y otras exógenas. Existen 3 pilares de la homotoxicología en la estrategia terapéutica: 1. Drenaje y detoxificación; 2. Inmunomodulación y 3. Apoyo orgánico celular, medidas de drenaje y detoxificación (fármacos reguladores de la inflamación). Además de activar los mecanismos de defensa, el drenaje también es un factor crucial; incluso se pueden estimular los procesos inflamatorios para conseguir la “purificación” rápida de los tejidos intoxicados. A esto se le denomina “evolución hacia la salud” forzada o espontánea, o desplazamiento sintomático, así mismo cuando empeora la intoxicación sin tratamiento se le llama “evolución hacia la enfermedad”.5
El tratamiento con medicamentos antihomotóxicos puede acelerar significativamente el proceso de recuperación y mejorar el pronóstico de las enfermedades en las fases humorales o iniciales, con un riesgo bajo de efectos secundarios. La medicina antihomotóxica ofrece la ventaja de tratar ciertas enfermedades con la misma eficacia con la que actúan los medicamentos convencionales, pero sin afectar algún órgano. Además, se han reportado pocos efectos secundarios, contraindicaciones, y ausencia de interacciones con otros medicamentos; lo que resulta en una terapia segura, eficaz y clasificada como una medicina complementaria o suave. 5
Uno de los medicamentos antihomotóxicos utilizado para el tratamiento de inflamación, traumatismos, procesos degenerativos y para prevenir la mucositis inducida por quimioterapia es el Traumeel S®. Los efectos antiinflamatorios y analgésicos del Traumeel S® se han demostrado en ensayos clínicos y en modelos experimentales in vivo, incluyendo el test de edema inducido por carragenina y el test de artritis inducida por adyuvante.6 El Traumeel S® contiene extractos de plantas y minerales, todos ellos muy diluidos de la solución primaria y está compuesto por Árnica montana, Caléndula officinalis, Achillea millefolium, Matricaria chamomila, Symphytum officinale, Atropa belladonna, Aconitum napellus, Bellis perennis, Hypericum perforatum, Echinacea angustifolia, Echinacea pu rpúre, Hamamelis virginiana, Mercurius solubilis, Hahnemanni y Heparsulfuris. Al contrario de lo que ocurre con los medicamentos convencionales, la mayoría de los antihomotóxicos contienen microdosis o incluso nanodosis de los componentes activos y por lo tanto, no son tóxicas. 7
Se realizó un estudio experimental In Vitro en el cual se tomaron 36 micro diluciones, 30 con Traumeel S®, 3 controles (+) con Clorhexidina y 3 controles (-) con agua destilada desionizada, todas con cepas de Fusobacterium nucleatum. Las variables evaluadas fueron: Dosis mínima inhibitoria que se define como la concentración más baja de medicamento que previene el crecimiento visible de microorganismos luego de la exposición, entre 18 y 24 horas de cultivo. Dosis mínima bactericida, representa la mínima concentración capaz de matar al 99,9% de los microorganismos inoculados luego de 18 a 24 horas de cultivo. Efecto bactericida, cuando se produce la muerte de la bacteria y puede ir acompañada de la lisis de las células. Efecto bacteriostático, cuando se causa una parada del crecimiento bacteriano, pero no mueren de forma inmediata pero si se elimina, las bacterias pueden recuperarse y volver a crecer.
Una vez realizada la verificación para actividad antimicrobiana de las micro diluciones, se tomaron los microorganismos congelados a -20ºC y se realizaron las siembras en cajas de Petri con agar sangre suplementado, para activarlos es decir que estén aptos para el crecimiento. 7 días después se tomaron 3 unidades formadoras de colonias (UFC); se las llevó a tubos de 10 ml, que contenían agar Brucella como vehículo de transporte, necesario para no alterar sus células; seguidamente se comparó la turbidez (concentración de células equivalente a 300.000.000 por ml) por medio de la escala de McFarland (de 0,5 a 10), para determinar el número de bacterias por mililitro. Posteriormente se tomó la muestra y se cultivó en cajas de Elisa de 96 pocillos por triplicado, o sea, una muestra con el control positivo de clorhexidina, otra con el control negativo de agua, y la última con la micro dilución de Traumeel S®. Después de 48 horas de este último procedimiento, se observó el crecimiento de las colonias de Fusobacterium nucleatum, para saber si existía o no el efecto antimicrobiano y cuál era la concentración mínima inhibitoria, esto para determinar a qué porcentaje de dilución el Traumeel S® mostró por primera vez efecto antimicrobiano o control de viabilidad bacteriana.
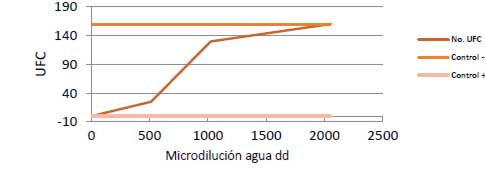
En el control (+) con clorhexidina en las diferentes diluciones, se evidenció ausencia de unidades formadoras de colonias bacterianas, debido al efecto bactericida del medicamento. En el control (-) con agua destilada desionizada (dd), se observó crecimiento elevado de unidades formadoras de colonias, debido a la ausencia del agente inhibidor del crecimiento bacteriano. (Gráfica 1).
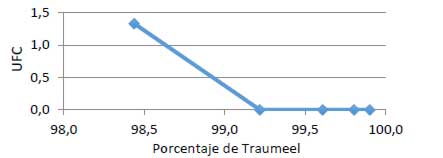
El efecto bactericida del Traumeel S® mostró cero crecimiento de las cepas de Fusobacterium nucleatum, con una concentración mínima de 99.2%. (Grafica 2).
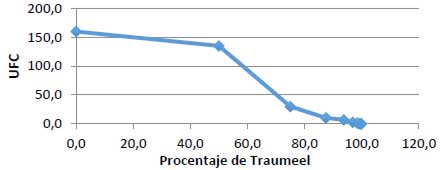
El efecto mínimo inhibitorio del Traumeel S® sobre cepas de Fusobacterium nucleatum fue a una concentración del 50% con un crecimiento de 135 UFC. (Grafica 3).
Aunque la enfermedad periodontal está estrechamente relacionada con el contexto socioeconómico como ocupación, ingresos, género y etnia, son los factores biológicos asociados a una deficiente higiene oral los que llevan a la pérdida de inserción del tejido conectivo y del hueso alveolar con formación de bolsas periodontales y la consiguiente pérdida dental.8 Desde hace varios años la enfermedad periodontal ha sido tratada con diferentes medidas terapéuticas dependiendo de su severidad y la condición del paciente.9
Ryan en 2005 realizó un estudio en el que comparó algunos tratamientos no quirúrgicos para la enfermedad periodontal, donde la opción más significativa fue el empleo de clorhexidina en una concentración de 0.12%, pero este antiséptico tiene una gran desventaja y es que con el uso frecuente puede producir pigmentación en dientes, lengua y teñir restauraciones dentales en algunos casos además de cambiar la percepción del gusto e inducir la formación de cálculo supragingival. 10 Esto difiere del Traumeel S® que es un concentrado con diferentes componentes naturales, cuyo uso promueve la cicatrización e induce una rápida desinflamación sin ocasionar efectos secundarios.
En 2012 Steinmann y col., emplearon el medicamento en pacientes con mucositis post tratamiento con quimioterapia y demostraron que los pacientes tratados con Traumeel S® presentaban mayores tiempos de analgesia que los pacientes tratados con un placebo. 11 Aunque los efectos encontrados in vitro no son directamente comparables con lo que sucede en el sistema periodontal, el uso del Traumeel S® es una buena alternativa en casos de rechazo a la clorhexidina y el presente estudio in vitro en el que cepas de Fusobacterium nucleatum se cultivaron en agar sangre suplementado con diferentes concentraciones de Traumeel S®, fue útil para encontrar la dosis mínima inhibitoria y la dosis mínima bactericida. Se puede observar que la metodología empleada en el presente trabajo está validada y es equiparable con la utilizada por Lafaurie y col., en un estudio realizado en 2009, donde se evaluó la efectividad antimicrobiana y antifúngica del ácido hipocloroso sobre microorganismos con potencial patogénico en cavidad oral y se encontró una efectividad del 100%.12
Svenco y col. en 2004, realizaron un estudio en pacientes diagnosticados con periodontitis, a quienes se realizó una terapia de raspado y alisado radicular y además de esto se empleó Traumeel S® como coadyuvante al tratamiento, comparando algunos componentes de la saliva como calcio, creatinina y fosfatasa alcalina, que están en concentración mayor en pacientes con enfermedad periodontal, demostrando que la terapia básica acompañada con medicina antihomotoxica disminuye los niveles de estos componentes salivares, hecho que ayuda al tratamiento óptimo de la periodontitis. 13
Birnesser y col., en 2005 realizaron un estudio en el que se comparó el uso de un AINES con Traumeel S® en pacientes con epicondilitis, evaluando diferentes signos y síntomas de la enfermedad; al realizar el sondaje, se encontró que no había una gran diferencia entre los pacientes tratados con las dos opciones, pero si se halló que varios pacientes tratados con AINES presentaron efectos adversos al medicamento por lo que debieron suspender su uso, mientras que ninguno de los pacientes que usaron Traumeel S® presentó algún síntoma adverso.14
Por otra parte, Smiian y col, en 2016 realizaron una evaluación de la eficacia del Traumeel en el tratamiento de sinusitis aguda en niños por medio de índices hematológicos y marcadores moleculares de inflamación. Los resultados mostraron que los pacientes tratados con Traumeel mostraron una disminución significativamente más rápida en los indicadores de intoxicación en sangre y los de inflamación.15
Las enfermedades periodontales se encuentran entre las infecciones crónicas más comunes en los humanos. La bacteriemia crónica de bajo nivel y una respuesta inflamatoria septicémica se han sugerido como un vínculo patogénico entre la enfermedad periodontal y otras enfermedades sistémicas.16 Todo esto aumenta significativamente la relevancia de la búsqueda de los medios para el tratamiento y la prevención de las enfermedades periodontales y para investigar el efecto de la medicación antihomotóxica del Traumeel S®.
El Traumeel S® tiene efecto antimicrobiano in vitro sobre cepas de Fusobacterium nucleatum.
El Traumeel S® podría ser recomendado como coadyuvante de segunda elección en el manejo postquirúrgico de la periodontitis en los casos que no se quiera utilizar la clorhexidina, pero se requieren más estudios in vitro para mostrar su eficacia en el control de otros periodontopatógenos.