Recibido para arbitraje: 05/06/2017
Aprobado para su publicación: 19/11/2017
El resultado estético de la rehabilitación con implantes, en la región anterior del hueso maxilar, depende del volumen óseo, la posición tridimensional de los implantes y la salud periimplantaria. Los cambios a nivel del alveolo post-extracción, comprometen la arquitectura del reborde alveolar, impidiendo la rehabilitacion implanto soportada. Este trabajo muestra una revisión de literatura y un caso clínico, donde la regeneración ósea guiada fue realizada simultáneamente con la instalación de implantes para el tratamiento de la fenestración y dehiscencia, que resultaron despues del fresado del reborde alveolar atrófico. En la técnica, fue utilizada matriz inorgánica bovina y membrana reabsorbible de colágeno porcino. Esta tecnica mostro ser muy previsible, disminuyendo el número de intervenciones quirúrgicas y el tiempo de tratamiento.
Palabras clave: regeneración ósea guiada, implantes, defectos óseos, biomateriales.
The esthetic result of the implant rehabilitation, in the anterior region of the maxillary bone, depends on the bone volume, the three-dimensional position of the implants and the peri-implant health. Changes at the level of the post-extraction alveolus compromise the architecture of the alveolar ridge, preventing implant-supported rehabilitation. This work shows a review of literature and a clinical case, where guided bone regeneration was performed simultaneously with the installation of implants for the treatment of fenestration and dehiscence, which resulted after the milling of the atrophic alveolar ridge. In the technique, a bovine inorganic matrix and a reabsorbable porcine collagen membrane were used. This technique proved to be very predictable, decreasing the number of surgical interventions and the treatment time.
Key words: guided bone regeneration, implants, bone defects, biomaterials.
Correspondencia: Jéssica Lemos Gulinelli. Departamento de Post Graduado - Sagrado Coração University - Irmã Arminda, 10-50. Jardim Brasil – Bauru – São Paulo Brazil - 17011-160. Phone: +55-43 999610060 e-mail: [email protected]
Inicialmente la implantología, se preocupaba por la instalación de implantes respetando la anatomía del hueso residual y descuidaba el resultado estético de la prótesis1. Con la previsibilidad de la osteointegración, los implantes dentales se han convertido en una alternativa segura para la rehabilitación de las áreas edéntulas2. Sin embargo, la atrofia alveolar puede limitar su indicación o poner en riesgo los resultados estéticos y funcionales de las rehabilitaciónes protésicas implanto soportadas, ya que para su éxito son fundamentales el volumen y la arquitectura del reborde alveolar3.
Actualmente casos más complejos se pueden tratar gracias a avances significativos en las técnicas de reconstrucción de rebordes atróficos y la ayuda de sustitutos óseos4.
La instalación del implante debe ser guiada por la restauración protética y no por el hueso disponible5. La arquitectura ósea determina el contorno y la posición del tejido blando periimplantar. En consecuencia, el volumen tridimensional del reborde alveolar es un factor determinante para un buen resultado estético 3,4,5,6.
A pesar de que la rehabilitaciónes con implantes, puedan ser indicadas en sectores con defectos óseos donde se permite la estabilidad primaria y la oseointegración, el resultado estético de tales rehabilitaciones puede verse comprometido. Las técnicas de regeneración ósea guiada (ROG) representan una alternativa para la obtención de resultados estéticos satisfactorios en la regeneración de defectos peri-implantares 7.
El objetivo de este trabajo es mostrar un caso clinico utilizando la tecnica de ROG simultanea a la colocación de implantes.
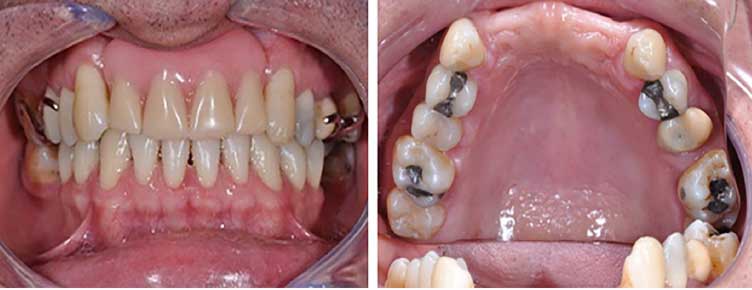
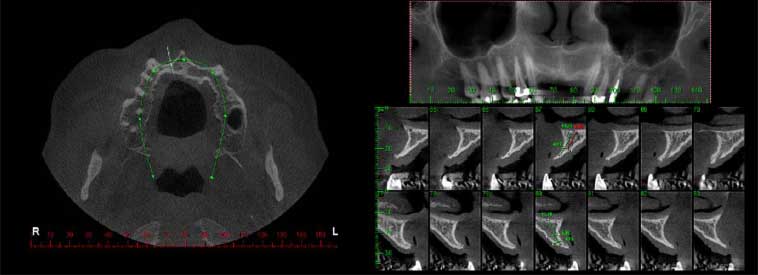
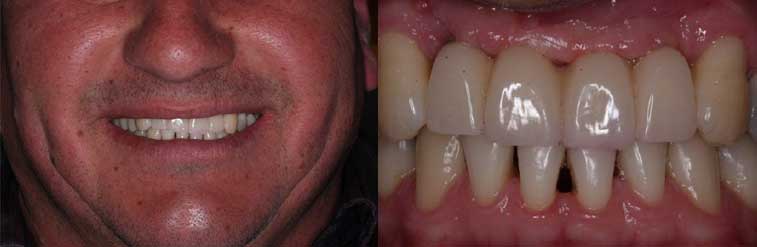
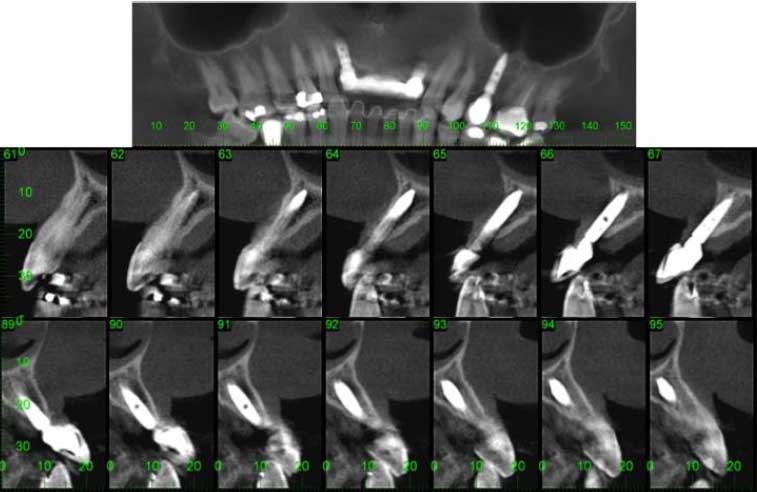
Paciente OBS, 44 años de edad, sexo masculino, con buen estado de salud general, se presentó a la clínica dental IMPPAR, con la queja principal de insatisfacción y deterioro estético causado por la pérdida de los dientes 1.2, 1.1, 2.1, 2.2. En el examen físico inicial intraoral el paciente tenía una prótesis parcial removible y aspectos de normalidad de los tejidos periodontales (Figura 1). La tomografia mostró una atrofia ósea Clase I Seibert 19937 y edentulismo parcial con la ausencia de dientes 1.2, 1.1, 2.1, y 2.2 (Figura 2).
Después de los examenes clínicos, se planificó realizar el tratamiento con el uso de implantes de diámetro reducido, simultáneos a la reconstrucción de la región anterior del maxilar atrófico, por medio de una regeneración ósea guiada, utilizando matriz ósea bovina (BioOss®-Geistlish) y membrana de colágeno porcino (BioGide® - Geistlish).
La planificación consistió con: el montaje del modelo en el articulador semi-ajustable, encerado diagnóstico, definición de la dimensión vertical, selección del tamaño y color de los dientes provisionales, prueba de dientes en cera, la confección de un guía quirúrgica y la preparación de una cubeta para la transferencia.
Como medicación preoperatoria, fue utilizada Ceradois 25 mg 1x día, ½ tableta de dormonid 15mg, profilaxis antibiótica con 1g de amoxicilina vía oral y terapia de corticosteroides con 8 mg dexametozona para control de dolor y edema. Se realizó la anestesia local con la infiltración de clorhidrato de mepivacaína 2% con epinefrina 1/100.000 (2% Scandicaine Especial Septodont, Brasil). Después de la antisepsia intraoral y extraoral, con una hoja de bisturi 15C se llevó a cabo la incisión y los tejidos fueron separadas con la exposición total de tejido óseo, la dirección de las perforaciones siguió la orientación de la guía quirúrgica para favorecer la biomecánica y el diseño de la prótesis planificada. Dos implantes Titamax Cone Morse EX (Neodent®) de diámetro 3,5 x 15 mm se colocaron en la región de las piezas dentárias 1.2 e 2.2.
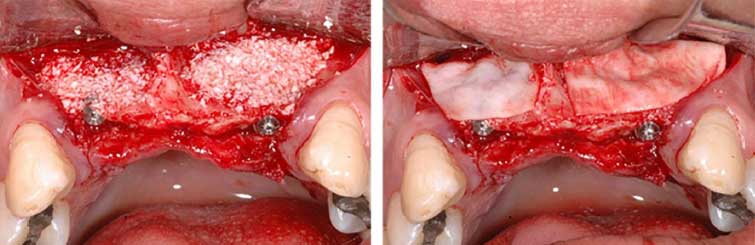
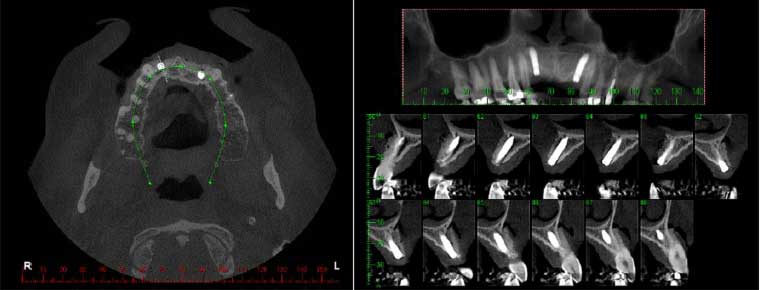
La estabilidad primaria fue de 45 Ncm, los pilares de 1 mm se colocaron para proteger la rosca interna del implante y la matriz ósea mineralizada bovina pequeña granular (0,25-1 mm de BioOss ®- Geistlich) previamente hidratado con solución salina, se aplicó en la región de la concavidad, a tal forma que cubra la superficie expuesta de los implantes y rellene el defecto bucal, la zona fue cubierta con la membrana de colágeno (Bio-Gide®-Geistlich)(Figura 3). La sutura de los tejidos se realizo con nylon 5-0 (Ethicon, Johnson & Johnson). Después de la intervención quirúrgica se realizó el reembase de la prótesis y tomografía postoperatoria (Figura 4). Las suturas se retiraron después de ocho días.
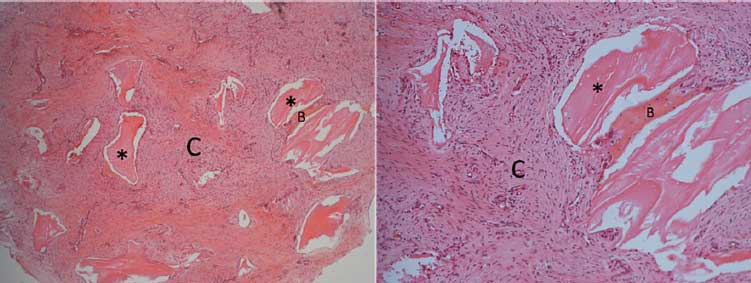
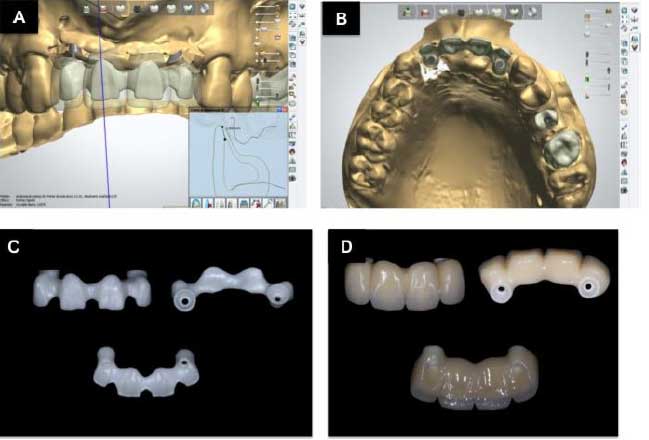
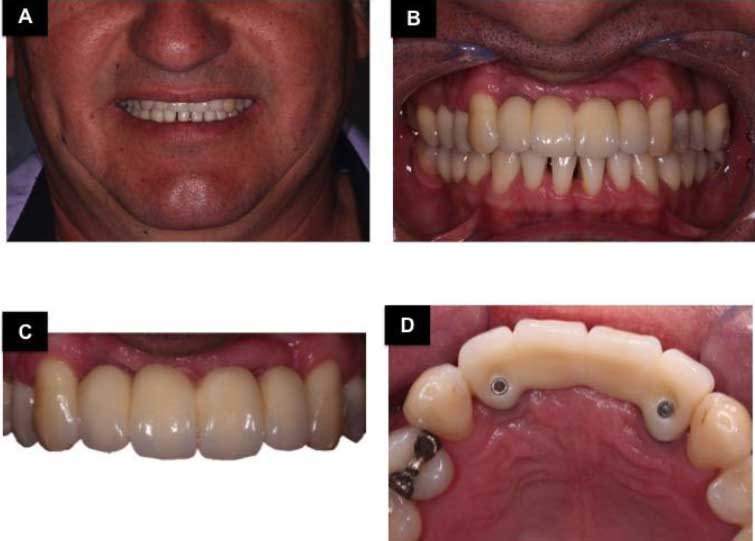
Después de nueve meses, la segunda etapa quirúrgica consistio en la colocación de pilares de cicatrización, y se aprovecho este momento para recoger muestras para el examen histológico de la región injertada. Después de la anestesia local, se realizo una incisión para levantar el colgajo y recoger el material con una trefina 4,1 mm. Luego se colocó los pilares de cicatrización y después de la sutura, el paciente fue orientado con una prescripción y guías postoperatorias. La muestra se envió para análisis histológico (Figura 5), donde se observó una presencia de remanente de biomaterial, recién formado trabéculas óseas e tejido conectivo de relleno. Transcurrido el período de cicatrización de los tejidos blandos, comenzó la fase de prótesis con instalación de mini-pilares, la impresión fue realizada y la prótesis provisional fue instalada y ajustada. Después se revisó la prótesis provisional y sólo después se le dio alta para la fabricación de la prótesis definitiva (Figura 6). La prótesis de cerámica libre de metal se hizo utilizando la tecnología CAD CAM (Figura 7,8). El caso clinico esta ilustrado con control tomográfico y clínico de 4,3 años (Figura 9), sin dolor y movilidad de los implantes, la higiene y la función eficaz, lo que sugiere el éxito de la técnica.
La tasa de sobrevida de los implantes colocados previamente a tratamientos regeneradores, son similares a los de los implantes instalados en hueso nativo8,9. Tales resultados demuestran las propiedades biomecánicas satisfactorias del tejido óseo recién formado, que presenta una mayor resistencia a la extracción del implante cuando se coloca en las zonas injertadas con hidroxiapatita bovina en comparación con hueso autógeno10 . Las propiedades mecánicas del hueso formado alrededor del biomaterial - Bio-Oss®, tiene una tendencia a mejorar con el tiempo debido a la remodelación y sustitución por hueso laminar11.
Algunos autores recomiendan el uso de hueso autógeno particulado en la superficie del implante que será cubierta con Bio-Oss®. De esta manera, se aprovechan las propiedades osteogénicas de los injertos autógenos particulados, lo cual acelera el periodo de reparo óseo, mientras que el material de relleno ayuda a mantener el volumen formado en el reborde alveolar9,10,11,12,13,14. Esta técnica ofrece la ventaja de eliminar una pequeña cantidad de hueso autógeno, garantizando que la superficie del implante este sólo en contacto con el hueso10. Por otra parte, los estudios histológicos muestran que se produce la formación de tejido óseo alrededor de las partículas de matriz inorgánica bovina, evitando su contacto con la superficie del implante1-14,15. Por lo tanto, Bio-Oss® puede ser utilizado directamente en los implantes sin comprometer la osteointegración1-10,11. Este hecho era evidente en el examen histológico, en el que se observó el hueso recién formado alrededor de los biomateriales, nueve meses después de la reconstrucción.
En el caso mostrado, Bio-Oss® se hidrató con solución salina para facilitar la manipulación. Sin embargo, algunos autores sugieren que las partículas deben mezclarse solamente con la sangre del paciente, que contiene la actividad esencial de componentes osteogénico, argumentando que el uso de solución salina puede saturar los poros del material y en consecuencia una alteración de su colonización por las células progenitoras óseas10.
La selección de la membrana Bio-Gide® se justifica porque su reabsorción es más lenta cuando son comparadas con otras membranas de colágeno disponibles en el mercado6,7,8,9,10,11,12 los estudios muestran resultados favorables con su uso10 y un aumento del reborde horizontal13. Resultados de un estudio14 demostraron que no había diferencia estadísticamente significante en el porcentaje de reducción del área de los defectos cuando la membrana Bio-Gide® se comparó con la membrana de e-PTFE. Debido a sus mejores características mecánicas y al control del período de tiempo de la función de barrera, el uso de membranas no reabsorbibles de politetraflouretileno expandido (e-PTFE) dan mayor cobertura de los defectos óseos. Por otra parte, estas membranas están asociadas a un mayor riesgo de complicaciones debido a la exposición de los mismos8.
En el análisis microscópico se permitió la observación de partículas del biomaterial, se observó un pequeño número de hueso trabécular recién formado y relleno de tejido conectivo. La divergencia de los resultados, tanto entre los estudios 6,7,8,9-15,16,17,a18, en comparación con el caso clinico presentado, pueden ser justificados por varios factores que afectan el éxito de la ROG, como la preservacion del espacio, la protección y la conservación del coágulo, sutura de los tejidos blandos por primera intención, la prevención de las fuerzas de impacto sobre el área a ser regenerados en el postoperatorio9 y el tipo de defecto 6.
En este caso, la membrana no estaba asegurada mediante suturas o tachuelas. El micromovimiento de las membranas no reabsorbibles no fijadas, resultan en la ruptura de la superficie del coágulo y permiten la formación de una capa de tejido blando entre la membrana y el coágulo, lo que disminuye la cantidad de hueso recién formado. Por otra parte, la formación de esta capa de tejido blando puede resultar en el aislamiento de las partículas de Bio-Oss, evitando así su reabsorción9. La estabilización de los anclajes de la membrana bucal y lingual/palatal, inmoviliza el material de relleno, lo que permite la formación de hueso deseado13.
El número de paredes del defecto tratado en este caso también tiene una influencia negativa en la formación del hueso, ya que este tiene una sola pared, lo que aumenta la distancia a recorrer por las células angiogénicas y osteogénicas para el cierre total de defecto con tejido óseo6. Cuando es mayor la cantidad de paredes, se permite el mantenimiento de espacio, la estabilidad del injerto, la migración celular y el aporte de sangre para todas las paredes óseas 19.
La regeneración ósea guiada simultánea a la colocación de implantes para el tratamiento de dehiscencias y fenestraciones, muestran previsibilidad y un resultado biológico y estético importante, lo que permite la regeneración peri-implantar con menor número de intervenciones quirúrgicas, una menor morbilidad y un reducido en el tiempo de tratamiento.