Recibido para Arbitraje: 10/05/2018
Aceptado para Publicación: 21/05/2018
La mucositis bucal (MB) se caracteriza por la presencia de lesiones eritematosas, erosivas y ulcerativas de la mucosa oral no queratinizada y se desarrollan como consecuencia de la terapia farmacológica oncológica que induce la formación de especies de oxígeno reactivas, que son capaces de causar daño oxidativo al afectar al endotelio vascular en primer término, seguido de los fibroblastos y queratinocitos a través de una respuesta inflamatoria mediada por la activación del factor de transcripción nuclear NF-kB, que estimula la formación de citocinas que atraen a los neutrófilos y macrófagos, los cuales inducen la elaboración de más especies de oxígeno reactivas y de lisozimas que causan la necrosis y apoptosis de las células afectadas. Adicionalmente se liberan metaloproteinasas de matriz que degradan al tejido conectivo y los factores de crecimiento se ven disminuidos interfiriendo en la cicatrización del epitelio bucal. Parece critica la fase de iniciación y el conocimiento de los procesos biológicos que en esta se suceden pueden abrir el camino para identificar individuos con mayor riesgo de desarrollar MB y blancos terapéuticos, que sirvan para el diseño de protocolos de atención al paciente oncológico que busquen prevenir la aparición de estas las lesiones.
Palabras clave: Mucositis, etiología, citocinas, inflamación.
Oral mucositis (OM) is characterized by the presence of erythematous, erosive and ulcerative lesions of the oral non-keratinized mucosa and develops as a consequence of oncological pharmacological therapy that induces the formation of reactive oxygen species, which are capable of causing oxidative damage by affecting to the vascular endothelium in the first place, followed by the fibroblasts and keratinocytes through an inflammatory response mediated by the activation of the nuclear transcription factor NF-kB, which stimulates the formation of cytokines that attract neutrophils and macrophages, which induce elaboration of more reactive oxygen species and lysozymes that cause necrosis and apoptosis of the affected cells. Additionally, matrix metalloproteinases are released that degrade the connective tissue and growth factors are diminished interfering with the healing of the buccal epithelium. It seems critical the initiation phase and the knowledge of the biological processes that occur in this can open the way to identify individuals with a higher risk of developing OM and therapeutic targets, which serve for the design of oncological patient care protocols that seek prevent the onset of these injuries.
Key words: Mucositis, etiology, cytokine, inflammation.
Correspondencia: José Gabriel Zambrano. Universidad Central de Venezuela, Facultad de Odontología, Cátedra de Histología. [email protected]
Una alta proporción de pacientes con cáncer desarrollan manifestaciones bucales durante la administración de la quimioterapia, como infecciones (bacterianas, virales y micóticas) y Mucositis Bucal (MB)1,2,3
La MB, producida por la quimioterapia, es un proceso patológico complejo producto de una exacerbada respuesta inflamatoria, que trae como consecuencia una desregulación en la expresión de citocinas inflamatorias que causa lesión en las células endoteliales, fibroblastos y matriz extracelular del tejido conectivo, además de los queratinocitos orales. Como consecuencia de la respuesta inflamatoria descontrolada surge a partir del tercer día luego de iniciado el tratamiento antineoplásico, eritemas que progresan a erosiones y úlceras crateriformes en boca, muy dolorosas que afectan significativamente la calidad de vida de los pacientes.1,2,3
En estudios longitudinales realizados en pacientes con MB, candidiasis bucal e infección por el virus del herpes simple se han identificado alteraciones en la expresión en el plasma sanguíneo y en la saliva de citocinas inflamatorias (TNF-α, IL- 6 y- 8), este desbalance genera daño celular, el cual es responsable del desarrollo de lesiones en la mucosa bucal y que pudiera ser empleado con fines predictivos.4,5,6,7,8 En este sentido es necesario estudiar los componentes implicados en la respuesta inmune local, responsables del desarrollo de lesiones, especialmente de MB, con el fin de identificar factores de riesgo y blancos terapéuticos.9,10 Por esta razón se plantea realizar una revisión bibliográfica con el objetivo de describir los mecanismos involucrados en el desarrollo de la MB inducida por quimioterapia y estudiar el papel de las citocinas inflamatorias en el desarrollo de estas lesiones.
La MB se define como un proceso patológico complejo en donde se produce daño microvascular, desregulación de la expresión de citocinas inflamatorias, reacción de la matriz extracelular e interacciones con la flora microbiana de la cavidad bucal11. Los eventos relacionados con su patogénesis han sido divididos en cinco etapas que se detallan a continuación:
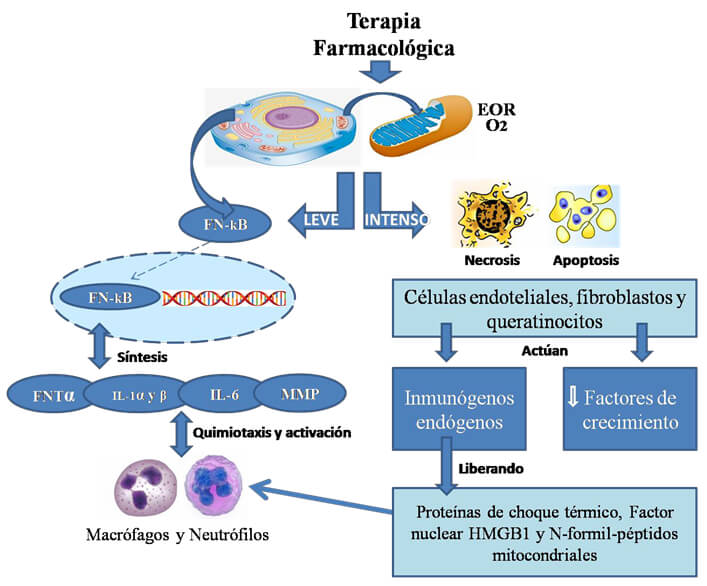
Esta fase se ubica entre el inicio y los dos días posteriores a la administración de los quimioterapéuticos, los cuales tienen la capacidad de producir estrés oxidativo a la célula, es decir un aumento en la cantidad de especies de oxígeno reactivo en el citoplasma, que constituyen productos metabólicos de la respiración aeróbica, siendo el anión superóxido (O2) el más involucrado en la patogénesis de la MB. Cuando el estrés oxidativo es leve, se activa el factor de transcripción nuclear FN-KB que se localiza en el citoplasma induciendo la activación en el núcleo de genes que codifican la producción de proteínas que son factores proinflamatorios, como FNT-α, IL-1α y -β. Cuando se trata de estrés oxidativo intenso se produce daño en el ácido desoxirribonucleico (ADN), en los lípidos y las proteínas celulares lo que trae como consecuencia necrosis o mecanismos apoptóticos inducidos por el gen supresor tumoral p53.12,13,14,15,16,17,18,19,20
Las células endoteliales, queratinocitos y fibroblastos afectados actúan como inmunógenos endógenos que liberan al medio extracelular proteínas de choque térmico, factor nuclear HMGB1 y N-formil-péptidos mitocondriales, que en conjunto se denominan moléculas de patrones asociadas a daño endógeno. Estas moléculas estimulan aún más la transcripción del factor de transcripción nuclear FN-kB tanto en las células de la mucosa oral como en las células inflamatorias y además inducen la liberación de cantidades adicionales de citocinas inflamatorias.12,13,14,16,17,21
A pesar de que en el pasado se manejaba que el daño inducido por el estrés oxidativo se sucedía en los queratinocitos mucosos, estudios recientes han demostrado que el blanco de afección inicial son las células endoteliales que revisten los vasos sanguíneos del corion y luego se extiende a los fibroblastos, lo que a su vez produce disminución en la secreción del factor de crecimiento epidermal (EGF) y endotelial vascular, afectando la proliferación de los queratinocitos de la mucosa bucal.12,13,14,16,17,21
Se presenta en el periodo entre el segundo y el tercer día de iniciada la quimioterapia, en donde la transcripción del factor NF-KB, estimula aún más la apoptosis y la síntesis de citocinas inflamatorias, sumándose en esta fase la IL-6, la cual se elabora en mayores cantidades. Asimismo estas citocinas inflamatorias contribuyen a la angiogénesis y al aumento de la permeabilidad vascular, lo que trae como consecuencia una mayor difusión de las drogas citotóxicas hacia la mucosa bucal, lo que incrementa su efecto sobre esta y estimula la mayor expresión de moléculas de adhesión celular las cuales contribuyen con la migración inicial de macrófagos y neutrófilos activados hacia el sitio inicial del daño.12,13,14,15,16,17
También estimula la síntesis de metaloproteinasas (MMP -3, -9 y -12) que degradan el colágeno alterando la estructura de la matriz extracelular del tejido conectivo de la mucosa y submucosa oral. Al estar desorganizada la matriz extracelular se corta la vía de señalización entre el epitelio y el mesénquima, interfiriendo de esta forma con la proliferación, migración y diferenciación de los queratinocitos.13,14,15,16,17
Esta fase va del tercer al quinto día después de iniciada la quimioterapia, presentándose una magnificación de la respuesta inicial al daño causado por las drogas, por un proceso de retroalimentación positiva, en donde el aumento de los niveles de FNT-α y la IL-1α y -β, incrementan la transcripción del factor NF-KB, con el aumento de sus efectos apoptóticos, en la proliferación y diferenciación de los queratinocitos, en el aumento de la permeabilidad vascular y en la migración y activación de células inflamatorias como los macrófagos y neutrófilos, células que tienen la capacidad no solamente de producir aún más cantidad de TNF-α y de IL- 1, sino también de sintetizar especies de oxígeno reactivas y lisozimas que se vierten hacia la mucosa bucal, creando un círculo vicioso de daño tisular que no se detiene y que deriva en una respuesta inflamatoria exacerbada que se traduce clínicamente en la aparición de los primeros signos de la MB como es el eritema difuso asociado a sintomatología dolorosa.13,14,15,16,22
Ocurre aproximadamente entre el séptimo y décimo día del inicio de la quimioterapia. La acumulación de los efectos que se han suscitado en las fases anteriores continúan inhibiendo la proliferación de los queratinocitos y aumentando la actividad apoptótica, causando la perdida de continuidad del epitelio y la exposición al medio bucal del tejido conectivo, favoreciendo la colonización secundaria de las lesiones por microorganismos que estimulan aún más la respuesta inflamatoria, lo que trae como consecuencia un incremento de la migración de neutrófilos y macrófagos, al sitio de la infección.
La activación de estas células produce citocinas inflamatorias (TNF-α, IL-1α y -β y -6), especies de oxígeno reactivo y lisozimas, responsables de la magnificación del daño en la mucosa bucal.13,14,15,16
Se produce entre la segunda y tercera semana de la quimioterapia, iniciándose el proceso de cicatrización de las úlceras que va a terminar en una remisión completa de la lesión, participando activamente la cicloxigenasa 2, como factor angiogénico que contribuye a la reparación del daño causado en la matriz extracelular del tejido conectivo de la mucosa y la submucosa oral, paralelamente el proceso reparativo del conectivo a través del factor de crecimiento fibroblástico y el factor endotelial vascular, envía señales a los queratinocitos de la capa basal del epitelio adyacente a las úlceras para que proliferen y migren reparando la lesión y restableciendo la estructura normal del epitelio mucoso.13,14,15,16,23
El daño inicial causado por los quimioterapéuticos a las células endoteliales y posteriormente al fibroblasto y queratinocito se debe a la liberación de especies de oxígeno reactivas muy especialmente el anión superóxido, clave para estimular la trascripción del factor NF-kB, la necrosis y la apoptosis lo que desata una intensa respuesta inflamatoria responsable del daño al epitelio a través de la alteración en la liberación de factores de crecimiento para el queratinocito.
La respuesta inflamatoria esta mediado por citocinas como el FNT-α, y las IL-1α, -β y -6, que estimulan la producción de cicloxigenasa 2 y la síntesis de MMP que a su vez aumentan el infiltrado inflamatorio y generan la activación de células inmunes que contribuyen en la patogénesis de la MB (Imagen 1).
Todos los eventos señalados previamente se corresponden a cambios clínicos como eritemas, erosiones y ulceraciones en la mucosa bucal que producen dolor intenso y compromiso sistémico debido a que interfiere con la alimentación de estos pacientes. Pareciera ser que el conocimiento de los mecanismos de daño oxidativo, causado por las especies de oxigeno reactivas, que suceden en la etapa de iniciación de la MB abren las puerta para la investigación de nuevas terapias que busquen prevenir la aparición de estas lesiones en el paciente oncológico.
Todas las investigaciones apuntan, que en la patogénesis de la MB es crítica la fase de iniciación mediada por las especies de oxígeno reactivas (EOR), las cuales son inducidas por la farmacoterapia oncológica, activando la transcripción del factor NF-KB lo que produce la síntesis de citocinas inflamatorias que estimulan la migración de neutrófilos y macrófagos, todo ello impulsando tempranamente daño en el endotelio vascular, seguido de la matriz extracelular y por último de los queratinocitos.
Además parece ser crucial la fase de amplificación, en donde se desarrolla una respuesta inflamatoria incontrolada, que agrava el daño tisular y que se corresponde clínicamente con la aparición de eritemas y ulceraciones en la mucosa bucal no queratinizada. La comprensión de estos mecanismos abre un abanico de oportunidades para la realización de investigaciones que busquen estudiar los efectos de medicamentos y terapias antioxidantes y anti-inflamatorias en la prevención de la MB y la utilización de niveles de citocinas inflamatorias y de metabolitos de las EOR en saliva o sangre, para la identificación de individuos con alto riesgo de desarrollar esta lesiones durante la quimioterapia. En un futuro, estos avances podrían incorporarse como parte del protocolo de atención al paciente oncológico mejorando así su calidad de vida.