Recibido para arbitraje: 02/09/2018
Aprobado para su publicación: 30/11/2018
La saliva es un líquido que cumple función antimicrobiana, de lubricación, capacidad amortiguadora, entre otras. En la enfermedad renal la misma se encuentra alterada, evidenciando manifestaciones bucales como xerostomía, disgeusia y alteraciones en niveles de algunos elementos del organismo. La saliva es un medio diagnóstico no invasivo que puede ayudar en el manejo del paciente con enfermedad renal. El objetivo de esta revisión bibliográfica fue analizar el papel de la saliva en el enfermo renal destacando los cambios que presenta y cómo puede utilizarse como herramienta diagnóstica. Material y método: Se hizo una búsqueda exhaustiva desde 1976 hasta 2018, en los idiomas: inglés, español y portugués. Las palabras de búsqueda fueron: Saliva, enfermedad renal, salud bucal, diagnóstico. Los buscadores utilizados fueron: PubMed, Cochrane Library, EBSCO-Host y Scopus. Los resultados indicaron que existe limitada información con respecto a la saliva de los enfermos renales y la saliva como medio diagnóstico particularmente para este grupo. Conclusión:. Son muchos los biomarcadores que pueden ser detectados en saliva, y de una manera fácil, no invasiva y sin dolor proveer información del estado general de muchos componentes que están en circulación en el enfermo renal. Se necesita indagar más en esta área para buscar la correlación en sangre y saliva y aportar evidencia científica de uso confiable.
Palabras clave: Saliva, enfermo renal, diagnóstico.
Saliva is a liquid that fulfills antimicrobial function, lubrication, buffer capacity, among others. In kidney disease it is altered, showing oral manifestations such xerostomia, dysgeusia and alterations in levels of some elements of the body. Saliva is a non-invasive diagnostic tool that can help in the management of patients with kidney disease. The aim of this literature review was to analyze the role of saliva in renal patients, highlighting the changes it presents and how it can be used as a diagnostic tool. Material and method: An exhaustive search was made from 1976 to 2018, in the languages: english, spanish and portuguese. The search words were: Saliva, kidney disease, oral health, diagnosis. The search engines used were: PubMed, Cochrane Library, EBSCO-Host and Scopus. The results indicated that there is limited information regarding the saliva of renal patients and saliva as a diagnostic medium particularly for this group. Conclusion: There are many biomarkers that can be detected in saliva, and in an easy, non-invasive and painless way to provide information on the general state of many components that are circulating in the renal patient. More research is needed in this area to look for the correlation in blood and saliva and provide scientific evidence of its reliable use.
Key words: Saliva, kidney disease, diagnosis.
Autor de correspondencia: [email protected]
La saliva es un líquido del ecosistema bucal que, en cierta medida, refleja el estado local de la cavidad bucal o general del cuerpo humano. Además es fácil de recolectar y puede usarse como herramienta de diagnóstico no invasiva.1
Son muchas las funciones que se le atribuyen a la saliva, incluyendo el mantenimiento de una mucosa oral húmeda. Las mucinas forman una capa viscosa en toda la superficie de la boca y actúan como un lubricante durante la masticación, la deglución y el habla. La saliva proporciona el líquido en el que los saborizantes sólidos pueden disolverse y distribuye los saborizantes alrededor de la boca a las ubicaciones de las papilas gustativas. También actúa como un amortiguador para proteger la mucosa oral, faríngea y esofágica del ácido ingerido por vía oral o del ácido regurgitado del estómago y contiene agentes antibacterianos, antivirales y antifúngicos que modulan la flora microbiana bucal de diferentes maneras.2
La insuficiencia renal es un proceso que conlleva a una pérdida de la capacidad funcional de las nefronas, independientemente de su etiología, causando diversas alteraciones sistémicas, incluidas complicaciones bucales, como variaciones en el flujo y composición de la saliva3. La enfermedad renal crónica (ERC) es un importante problema de salud en todo el mundo, con una incidencia de 337, 90, 107 y 95 casos nuevos por millón por habitante/cada año en Estados Unidos, Australia, Nueva Zelandia y el Reino Unido, respectivamente4 con una tendencia a aumentar entre 10 a 15 % anualmente5. Específicamente en países occidentales es de aproximadamente 200 casos por millón.6
Durante la progresión del daño renal, las manifestaciones clínicas se notan en prácticamente todos los órganos y sistemas; específicamente en el área bucal, 90% de todos los pacientes experimentan signos y síntomas bucales. Las opciones de manejo existentes van desde cambios en la dieta y estilo de vida, a diferentes terapias de remplazo renal (hemodiálisis y diálisis peritoneal) o trasplante renal.4
Se realizó una búsqueda bibliográfica con el objetivo de identificar los artículos relacionados con la saliva de enfermos renales. Se hizo una revisión exhaustiva en la literatura electrónica desde 1976 hasta 2018, en los idiomas: inglés, español y portugués. Las palabras de búsqueda fueron: saliva, renal disease, oral health AND/OR saliva, enfermedad renal, salud bucal AND/OR, saliva, doença renal, saúde bucal. Los buscadores utilizados fueron: PubMed, Cochrane Library, EBSCO-Host y Scopus.
Los criterios de inclusión fueron los siguientes: 1) Artículos originales y revisiones. 2) Delimitación del idioma (castellano, inglés y portugués). 3) Limitados al periodo 1976 a 2018. 4) Relacionados con el tópico de revisión: saliva y enfermedad renal.No se hicieron restricciones por edad ni sexo. Se excluyeron editoriales, cartas al director, tesis, periódicos y comentarios de expertos.
Los artículos utilizados en esta revisión bibliográfica de tipo narrativa fueron recolectados en el software Zotero, el cual permite eliminar referencias duplicadas.
Inicialmente la búsqueda arrojó de 1172 artículos, de los cuales fueron excluidos en una primera selección 700, de los mismos 60 artículos se seleccionaron, fueron analizados y discutidos, considerándose elegibles para su inclusión en este estudio.
Los textos completos de los artículos fueron evaluados por un solo revisor de acuerdo a los criterios mencionados anteriormente.
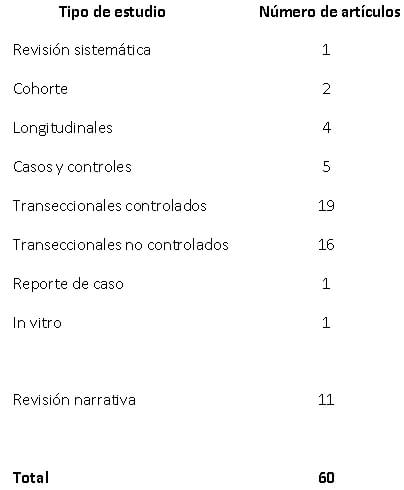
Los resultados de esta búsqueda indicaron que existe limitada información con respecto a la saliva de los enfermos renales y la saliva como medio diagnóstico particularmente para este grupo. En su mayoría el tipo de estudio es el transeccional controlado (31,66%) seguidos de los transeccionales no controlados (26,66%).
Los niños con ERC desarrollan muchos cambios metabólicos en la sangre que a menudo requieren un análisis bioquímico frecuente. El análisis de suero es un proceso invasivo y doloroso. Sería de gran beneficio para esta población, el uso de un proceso alternativo no invasivo para el análisis de biomarcadores. Renda et al. propusieron por medio de su estudio esta alternativa por la correlación positiva que encontraron entre los niveles de creatinina en suero y saliva en niños con ERC. Además la saliva puede ser recolectada sin personal médico.7
La creatinina plasmática y la urea son marcadores comúnmente utilizados para medir la función renal en la insuficiencia renal aguda y crónica. La recolección de sangre repetida generaestréspara el paciente cada vez que se hace el procedimiento. La saliva ofrece el potencial de ser un fluido diagnóstico alternativo8. Pandia et al. al estudiar pacientes con ERC, diabéticos e hipertensos demostraron que la saliva puede emplearse como una herramienta de diagnóstico no invasiva, potente y alternativa, lo que evita la extracción innecesaria y periódica de la sangre, que no solo es incómoda sino que también conlleva a un riesgo adicional de infección. El uso de urea y creatinina para diagnosticar la salud de los riñones es una práctica sencilla que puede hacerse a través de un análisis salival. Por lo tanto, la saliva tiene el potencial de revolucionar el protocolo de diagnóstico para pacientes con enfermedades renales.9
Se sabe que en el organismo existe un equilibrio oxidante-antioxidante y que puede alterarse debido a estrés, desequilibrios hormonales, desórdenes inmununológicos, traumas, entre otros. Cuando se pierde este equilibrio ocurre un estrés oxidativo. La evaluación del estado de estrés oxidativo en el fluido salival se ha propuesto como diagnóstico en el desarrollo y progreso de enfermedades generales como enfermedad periodontal, cáncer oral, diabetes, artritis reumatoide, insuficiencia renal crónica, síndrome de apnea obstructiva del sueño y VIH.1
Cuando se analiza la saliva de enfermos renales, se encuentran importantes patógenos en pacientes inmunocomprometidos como el citomegalovirus (CMV), el virus de herpes humano 6 (HHV-6), y el virus de herpes humano 7 (HHV-7), que pueden ser detectados en muestras salivales10. En pacientes trasplantados se han detectado virus como CMV y HHV6 en una frecuencia de hasta 70,4%. La asociación encontrada entre la eliminación del CMV en la saliva y la viremia del CMV en este estudio abre la posibilidad de futuros estudios sobre el uso de la carga viral en la saliva como un predictor de la viremia11.
A pesar de que hacen falta estudios sobre su presencia en la saliva de la población pediátrica, Caliento et al. encontraron que la eliminación oral del virus de herpes simple 1 (HSV-1) y virus Epstein Barr (VEB) fue significativamente mayor en los receptores de trasplante renal en comparación con grupo control12. Asimismo, los receptores de trasplantes renales excretaron virus herpes con más frecuencia que los controles, especialmente HSV-1 y VEB, siendo más frecuente la eliminación salival de HSV-1 en pacientes con trasplante renal reciente.13
El uso de medios diagnósticos alterativos se hace necesario en pacientes que cursan con alteraciones renales, ya que tienen mayor riesgo de eventos cardiovasculares. En los últimos años, han ido adquiriendo mayor importancia las toxinas unidas a proteínas, que han sido asociadas a mayor morbimortalidad y que se caracterizan por la dificultad para su depuración en diálisis14. Existen toxinas urémicas que en altas concentraciones están relacionadas con una falla renal progresiva como el p-cresyl sulfato, el indoxyl sulfato o la homocisteína, y que pueden ser diagnosticadas en saliva para saber sus niveles en circulación.15
La saliva es un material biológico de diagnóstico que contiene indicadores fácilmente medibles de procesos oxidativos que pueden proporcionar una herramienta para el desarrollo y monitoreo de afecciones patológicas locales que incluyen también la enfermedad periodontal o cáncer de cavidad bucal. Los avances actuales y la nanotecnología emergente, junto con el uso de marcadores proteómicos y genómicos del estrés oxidativo, contribuyen al hecho de que los diagnósticos de saliva se están convirtiendo en una herramienta muy sensible e importante.1
Las manifestaciones bucales de la enfermedad renal son comunes y pueden presentarse como signos únicos de una enfermedad multisistémica que afecta los riñones (como la vasculitis) o como patologías bucales que se encuentran con una mayor prevalencia en pacientes en etapa terminal.16
Alrededor del 90% de los pacientes con disfunciones renales manifiestan alteraciones bucales tanto en hueso como en tejidos blandos, incluyendo petequias y hemorragia gingival6. Los niños y adolescentes con ERC sometidos a hemodiálisis presentan manifestaciones directamente relacionadas con su estado17, las cuales van a variar una vez que se haga el trasplante renal.18,19
Estos hallazgos incluyen sensación de boca seca, pigmentación dental por suplementos de hierro, disminución en el flujo salival17defectos de esmalte20, cálculo dental21, retardo en la erupción22,23, agrandamientos gingivales24. También se ha observado hiperpigmentación anormal en labios, sangrado en encías, candidiasis25, palidez en mucosas, sabor alterado, halitosis26. Y se conoce que muchos de estos cambios pueden atribuirse a las alteraciones metabólicas producto de la insuficiencia renal.27
Solamente relacionado con saliva se reportan hallazgos como: xerostomía, disgeusia28 o sensación de quemazón. La ERC avanzada puede elevar los niveles de urea en saliva, así como los valores de pH salival.27
La xerostomía es definida como la sensación subjetiva de sequedad oral y es una condición importante que disminuye significativamente la calidad de vida29. Puede ser observada en pacientes renales debido a la restricción de ingesta de fluidos, efectos secundarios de algunos medicamentos, especialmente antihipertensivos, posible alteraciones en glándulas salivales y aliento secundario a problemas de perfusión pulmonar30. La xerostomía en pacientes sometidos a hemodiálisis tiene una etiología multifactorial debido a riesgos acumulativos como la edad avanzada, trastornos sistémicos, fármacos y fibrosis y atrofia parenquimatosa salival31, pero principalmente debido a la restricción de la ingesta de líquidos32. También una reducción en la secreción lagrimal y salival es frecuente en pacientes con diálisis a largo plazo. Tales alteraciones a menudo son asintomáticas y podrían ser la expresión de la aceleración de una disminuciónen la función glandular dependiente de la edad con fibrosis y atrofia concomitantes.33
Nascimiento et al. comprobaron esto al encontrar una asociación entre pacientes con baja ingesta de líquidos y consumo de medicamentos que conducen a hiposalivación y se consideran xerostomizantes24. Cuando se mide la función salival en pacientes con enfermedad renal se observa que el flujo salival tanto estimulado como no estimulado disminuye cuando se compara a grupo control34. La hiposalivación está relacionada con una mayor sensación de sed y aumento de peso en pacientes en hemodiálisis y se ha encontrado que la hiposalivación también está asociada con un gradiente elevado de sodio antes de la diálisis.35
La disgeusia es una sensación de sabor extraño presente en diferentes problemas sistémicos como alteraciones neurológicas, cáncer, cirrosis hepática, enfermedad renal. Diversas enfermedades, tanto agudas como crónicas, se asocian a alteraciones de la percepción sensorial, y pueden llegar a afectar a más del 50% de las personas mayores de 65 años. Los efectos provocados por los fármacos y algunos tratamientos como la quimioterapia y la radioterapia, juegan un papel importante en la distorsión sensorial y en la incidencia de malnutrición36. En el paciente que cursa con enfermedad renal se debe a varios factores28, entre los que se incluyen altas concentraciones de urea en saliva34, así como la disminución en el flujo salival.37
Son muy interesantes los hallazgos que se han encontrado en pacientes en estadios avanzados de ERC con síntomas urémicos superiores gastrointestinales. En particular, las concentraciones bajas de bicarbonato en saliva están asociadas a boca seca y ganas de vomitar. También los niveles altos de calcio en saliva están relacionados a boca seca, mientras que los de sodio y una mayor relación sodio/potasio en saliva se asocian a náuseas.38
Existe una sustancia llamada tiourea, que no todas las personas detectan fácilmente con el gusto. Los síntomas urémicos de cambios de sabor y náuseas, se han relacionado con la capacidad genética del paciente de probar la tiourea como amarga, en combinación con los compuestos activos que se encuentran en la saliva del paciente con ERC, que crea un impacto en la zona superior del tracto gastrointestinal.39
Los niveles de calcio, fósforo, magnesio, bicarbonato en saliva, varían de acuerdo al estado o fase en la que se encuentre el enfermo renal. Davidovith et al. encontraron que el nivel de calcio salival más alto lo tuvieron los pacientes prediálisis, el fósforo más alto lo tenían pacientes trasplantados y control, mientras que el magnesio salival más bajo se encontró en el grupo de diálisis. En todos los grupos (prediálisis, diálisis y trasplantados) la urea salival fue más alta que en el grupo control con un aumento de 2.5 veces en el grupo de diálisis40. Significa esto que la función renal esta estrechamente relacionada con los elementos excretados a nivel salival.
Los hallazgos sugieren que los pacientes en hemodiálisis presentan niveles elevados de componentes salivales (Ca, P y albúmina), y los cambios comúnmente observados en estos pacientes, como el hiperparatiroidismo, parecen tener una influencia en la composición salival.41
En enfermos renales los niveles salivales de calcio, fósforo, urea, sodio y potasio, son significativamente mayores comparados con grupo control, más no así el nivel de bicarbonato. En pacientes que están sometidos a diálisis, niveles elevados en estos elementos, se han correlacionado con la gravedad de la enfermedad renal42. También se ha sugerido que la sensación de boca seca en pacientes con ERC está asociada a la disminución de niveles de bicarbonato y aumento de calcio en la saliva43. La razón exacta de los síntomas urémicos aun se desconoce.44
Adicionalmente, se ha demostrado que elnitrógeno ureico en saliva es un predictor independiente de las causas de mortalidad en enfermos renales yse puede utilizar para detectar, diagnosticar y hacerle seguimiento al paciente con enfermedad renal aguda y crónica. Sus mediciones semicuantitativas mediante un simple método de tira reactiva en paralelo con una evaluación clínica pueden ayudar al diagnóstico de enfermedad renal aguda, especialmente en circunstancias de recursos limitados de atención médica. Obviamente se necesitan más estudios para conocer la capacidad de las tiras de nitrógeno ureico en saliva para detectar enfermedad renal en diferentes poblaciones y en entornos aún más rurales, y evaluar el impacto en el resultado del paciente de esta herramienta de diagnóstico45. Además los niveles de nitrógeno ureico en saliva son más bajos que el nitrógeno ureico en sangre46,47 y existe mayor concordancia entre ambos cuando los niveles de nitrógeno ureico en sangre son más altos45. Esto es importante tenerlo en cuenta.
Al analizar la concentración de urea en sangre y la concentración de urea salival en pacientes sometidos a diálisis y trasplante renal, se ha encontrado una correlación; lo que lleva a pensar que pronto se podrá hacer mayor uso de la saliva como herramienta diagnóstica no invasiva.42
Se ha propuesto que la estimación de la urea y la creatinina en la saliva y la tasa de filtración glomerular estimada calculada a partir de la creatinina salival, probablemente sean útiles como marcadores bioquímicos para diferenciar a los pacientes con insuficiencia renal de los sujetos sanos. Con respecto a otros parámetros salivales, se necesitan más estudios para establecer correctamente su papel.48
Pham et al. encontraroncorrelación positiva significativa entre la creatinina sérica y salival y entre la urea sérica y salival. La urea salival dio una sensibilidad de 82.9% y una especificidad de 57.8%. La creatinina salival dio una sensibilidad de 86.5% y una especificidad de 87.2%. Se destaca que son herramientas de bajo costo, fácilmente accesibles y no invasivas para la detección, el diagnóstico, el seguimiento de los resultados del tratamiento y la determinación del pronóstico de la ERC.49
Existen otros biomarcadores que pueden ser detectados en saliva, como lo son las inmunoglobulinas. La enfermedad renal, en particular durante el tratamiento de hemodiálisis, parece alterar los componentes inmunológicos e inflamatorios salivales. Por lo tanto, analizar los niveles de inmunoglobulinas en la saliva puede ser beneficioso para controlar la enfermedad renal50. Se ha señalado que las respuestas inmunes celulares y humorales se suprimen en la insuficiencia renal.51
Se han hecho mediciones de IgA en saliva y se ha encontrado que los niveles son menores en pacientes que están en diálisis51,52.Contrariamente, pacientes en hemodiálisis, han mostrado niveles significativamente más altos de IgG, IgA y Proteína C reactiva en comparación con los grupos control y con enfermedad renal crónica50. Esto indica que este tópico no se tiene muy claro y que hay que indagar más en el comportamiento de las inmunoglobulinas, dependiendo del estado en que se encuentre o progrese la enfermedad renal.
Todo lo anteriormente expuesto indica que es un campo donde debe haber mayor investigación y es mucho lo que puede aportar este tipo de pruebas inmunológicas.Otro aspecto que se ha estudiado es la microbiota en pacientes con IgA por nefropatía encontrándose también que la microbiota salival de estos pacientes difiere de grupos control.53
Mediciones objetivas han mostrado que los pacientes urémicos tienen peor salud bucal que los controles sanos y parecen desarrollar sus problemas dentales y bucales antes de que hayan progresado a diálisis54. Subramaniam et al. reportaron un pH salival promedio fue de 6.92 y la capacidad amortiguadora de la saliva estimulada fue de 9.86 en pacientes pediátricos con desórdenes renales.55
Se ha encontrado que los pacientes con enfermedad renal tienen una alta capacidad amortiguadora salival en 89,5% de los pacientes estudiados. Los niveles salivales de Streptococcus mutans y Lactobacillus acidófilos han sido significativamente más bajos en el grupo de enfermos renales que en los controles, probablemente debido al aumento de las concentraciones de sustancias químicas antibacterianas como la urea en la saliva de niños con ERC en estado terminal.56
Es muy interesante la predicción que puede hacerse al estudiar la microbiota oral, ya que se ha encontrado que la proporción de Neisseria/Veillonella en lingual mandibular anterior y Neisseria/Streptococcus en muestras salivales fueron los mejores biomarcadores de microbioma oral para predecir el diagnóstico de ERC, prediciendo correctamente el estado de la ERC en 81% y 77% de los casos, respectivamente. Si se replica de forma independiente, esta información podría ayudar a detectar la enfermedad en individuos sin ERC prevalente, o identificar a aquellos cuya enfermedad eventualmente progresará.57
Varios estudios muestran que los pacientes urémicos tienen mayor cantidad de dientes cariados, faltantes, pérdida de inserción y lesiones periapicales. La dentición deficiente y otros signos de mala salud bucal deberían ser un despertador también en las primeras etapas de la ERC.3,58,59
La alta prevalencia de caries y la subutilización de atención preventiva es una preocupación de los niños con enfermedad renal que están médicamente comprometidos y que deben tener monitoreo constante para evitar posibles infecciones dentales graves.60
La caries es una enfermedad multifactorial donde el flujo salival estimulado y la capacidad amortiguadora de la saliva son factores asociados. A medida que aumenta el intervalo de tiempo entre diálisis, el flujo salival disminuye así como la capacidad amortiguadora de la saliva, pero el pH salival aumenta con el tiempo.3
La alteración de la salud bucal puede ser un faro para graves problemas en pacientes con hemodiálisis propensos a infección. Por lo tanto, los pacientes en hemodiálisis deben someterse a exámenes y tratamientos dentales regulares. El examen dental regular y la instrucción en pacientes que esperan un trasplante renal son de vital importancia para garantizar una salud bucal óptima.3
La saliva en el enfermo renal ofrece una gama de información que en muchos casos se desconoce y se desaprovecha. A pesar de ser un liquido con el que se tiene contacto a diario, poco se usa como herramienta de estudio y diagnostico de enfermedades sistémicas.
Después de analizar los artículos seleccionados, hay varios aspectos importantes a considerar. Al estudiar en conjunto la información disponible, es imperativo en esta era de odontología basada en la evidencia, destacar cuáles son los estudios con mayor evidencia posible.
Entre toda la literatura encontrada y seleccionada, apenas se encontró una revisión sistemática, de resto la mayoría de revisiones son de tipo narrativa, que tienen poco nivel de evidencia científica. Los estudios de cohorte y longitudinales son igualmente escasos. Solo existe un estudio de cohorte que hace predicción entre la microbiota oral y la evolución de la enfermedad renal. Ensayos clínicos aleatorizados no fueron encontrados. Los estudios longitudinales a diferencia de los de cohorte, observaron a los pacientes enfermos renales en momentos diferentes, haciéndoles seguimiento, más no establecieron exposición en grupos para ver cuáles desarrollaban o no la enfermedad, por eso la diferencia en la clasificación62. (Tabla 1)
En su mayoría, lo que se encuentra publicado son estudios observaciones de tipo transeccional controlados, algunos diseños de casos y control y es muy común el reporte de hallazgos bucales en grupos de pacientes con enfermedad renal, sin control, donde se hacen simples descripciones de la condición bucal. Estudios que demuestren causalidad de enfermedad renal son pocos. Fueron reportados estudios de asociación, sin embargo, al analizar cada uno de ellos, muchos no miden exposición a factores de riesgo sino que simplemente comparan un grupo de pacientes enfermos con un grupo control.
Un aspecto también a destacar es que la mayoría de los artículos que se han reportado relacionados con saliva y enfermos renales fueron desarrollados en pacientes adultos y no en niños. Del total, apenas un 11,6% fueron realizados en pacientes pediátricos, aun cuando la enfermedad renal cada dia va en aumento en la población infantil. La disminución en la calidad de vida, la deserción escolar, así como las complicaciones que tienen el paciente pediátrico afectado renalmente, son aspectos importantes a destacar relacionados con la salud bucal y que merecen seguimiento, atención y estudio.
Las revisiones sistemáticas se consideran base para desarrollar recomendaciones para respaldar las decisiones en la práctica actual, por lo que su importancia es muy alta dentro de la evidencia científica. Además forman una base para las guías de práctica clínica y sugieren direcciones para nuevas investigaciones. Relacionadas con este tema solo se encontró una revisión sistemática. Al relacionar este aspecto es muy interesante señalar la revisión sistemática realizada por Andrade et al. quienes después de analizar todo lo reportado relacionado con caries dental y ERC, apenas seis (6) artículos cumplieron con los criterios de inclusión, llevándolos a concluir que los datos en la literatura apoyaban débilmente una menor prevalencia de caries en niños y adolescentes con ERC que en sus homólogos sanos63. Todavía faltan estudios bien diseñados que proporcionen una mejor evidencia científica que respalde esta conclusión. Sin embargo, esto es un concepto que se repite entre odontólogos con respecto a los enfermos renales y analizando esta revisión, la evidencia es diferente a lo que se cree.
Se tiene que considerar igualmente que la exploración de la saliva como medio diagnostico es un tema innovador, que tiene poco tiempo en estudio y que aun falta mucha más investigación. Sería de mucha ayuda aumentar este tipo de estudios utilizando la saliva como herramienta para diagnosticar o hacer seguimiento en el enfermo renal, así como hacer diseños de estudio con mayores fortalezas.
A pesar de todas las limitantes de esta revisión narrativa, la misma puede ser inicio para futuras investigaciones, así como para aumentar el conocimiento entre odontólogos hacia los beneficios que puede aportar la saliva y que muchas veces se desconocen.
El papel que juega la saliva en el enfermo renal merece estudio. Son muchos los biomarcadores que pueden ser detectados en saliva, y de una manera fácil, no invasiva y sin dolor proveer información del estado general de muchos componentes que están en circulación. Se necesita indagar más en esta área para buscar la correlación en sangre y saliva y aportar evidencia científica de su uso confiable.