Recibido para Arbitraje: 10/09/2018
Aprobado para su publicación: 05/03/2019
La erosión dental se define como la pérdida patológica, crónica e indolora de los tejidos dentales, por la acción química de ácidos no producidos por la microflora bacteriana bucal. Los estadíos más avanzados pueden generar diferentes niveles de desgaste y producir hipersensibilidad destinaria. Objetivo: evaluar y describir los cambios estructurales de la superficie dental erosionada pre y post tratamiento con bicarbonato de arginina y monofluorofosfato de sodio, observados mediante microscopia electrónica de barrido (MEB). Materiales y Métodos: Se realizó un estudio piloto de tipo descriptivo, transversal y cuasi-experimental. Se seleccionó una muestra de cuatro pacientes, previo consentimiento informado; de manera aleatoria se le asignó el tratamiento luego de la primera cirugía, grupo 1 (bicarbonato de arginina) y grupo 2 (monofluorofosfato de sodio). Las exodoncias se realizaron en dos tiempos (tiempo 0 y post-tratamiento) para obtener los especímenes y ser evaluados con MEB. Resultados: Tras la evaluación realizada por MEB se observó que los segmentos de esmalte dental diagnosticados clínicamente con grado 1 de erosión, ya presentaban exposición de algunos túbulos dentinarios en la superficie evaluada. Luego de 14 días de tratamiento, se observó que ambas cremas dentales fueron capaces de sellar la entrada de los canalículos dentinarios; sin embargo, la crema dental con bicarbonato de arginina, formó una estructura mineralizada que se depositó sobre la superficie dental. Conclusión: ambos tratamientos fueron capaces de producir cambios estructurales en la superficie dental erosionada sellando la entrada de los túbulos dentinarios.
Palabras clave: erosión dental, microscopia electrónica de barrido, hipersensibilidad, arginina, fluoruro.
Dental erosion is defined as the pathological, chronic and painless loss of dental tissues due to the chemical action of acids not produced by the oral bacterial microflora. The more advanced stages can generate different levels of wear and produce dentine hypersensitivity. Objective: to evaluate and describe the structural changes of the eroded dental surface before and after treatment with arginine bicarbonate and sodium monofluorophosphate, observed by scanning electron microscopy (SEM). Materials and Methods: A pilot study of descriptive, transversal and quasi-experimental type was carried out. A sample of four patients was selected, with prior informed consent; Randomly, he was assigned to the treatment after the first surgery, group 1 (arginine bicarbonate) and group 2 (sodium monofluorophosphate). Extractions were performed in two stages (time 0 and post-treatment) to obtain the specimens and be evaluated with SEM. Results: After the evaluation made by SEM, it was observed that dental enamel segments clinically diagnosed with erosion grade 1, already had exposure of some dentinal tubules in the evaluated surface. After 14 days of treatment, it was observed that both dental creams were able to seal the entrance of the dentinal canaliculi; however, the toothpaste with arginine bicarbonate, formed a mineralized structure that was deposited on the tooth surface. Conclusion: both treatments were able to produce structural changes in the eroded dental surface sealing the entrance of the dentinal tubules.
Key words: dental erosion, scanning electron microscopy, hypersensitivity, arginine, fluoride.
Autor de correspondencia: Montero Maglynert. [email protected]
Diferentes procesos de naturaleza no-microbiológica, pueden ser capaces de afectar la estructura dental de manera crónica e irreversible; entre ellos, la abrasión, atrición, abfracción y erosión1,2. El término erosión es empleado para describir la destrucción gradual de la superficie de un cuerpo, causada por procesos electrolíticos o químicos. La erosión dental se define como la pérdida patológica, crónica e indolora de los tejidos dentales, por la acción química de ácidos y/o quelantes no producidos por la microflora bacteriana bucal3.
Estudios longitudinales, muestran un incremento tanto de la prevalencia como de la severidad de la erosión dental, proporcional a la edad del individuo3,4,5. Torres et al., destacan que el incremento de la erosión dental está asociado a los hábitos alimenticios de las sociedades modernas4. En este sentido, se ha estudiado que la aparición de dicha alteración se relaciona con diferentes factores de riesgo (intrínsecos y extrínsecos) asociados siempre a la presencia de sustancias ácidas en la cavidad bucal de manera frecuente y continua5. Entre los factores intrínsecos se encuentran el reflujo de ácidos gástricos y el vómito recurrente. Los factores extrínsecos, serán aquellas sustancias que el individuo consume o utiliza de manera habitual como: bebidas carbonatadas, ácidas, energizantes, alcohólicas y el consumo de cualquier otro tipo de alimento con alto contenido ácido 5.
Las características fisicoquímicas del esmalte dental, representado como un sólido cristalino, dependerán de la composición y la conducta química de los líquidos que lo rodean6. Los principales factores que rigen la estabilidad de la apatita del esmalte son: el pH salival y las concentraciones iónicas de calcio, fosfato y fluoruro en la solución, dichas concentraciones varían en cada individuo. La disminución del pH en los líquidos que bañan al diente, aumenta drásticamente la solubilidad de la apatita del esmalte, debido a que la concentración de iones amortiguadores en la solución se encuentra inversamente proporcional a la concentración de hidrogeniones6. Las insaturaciones de los fluidos provocará la desmineralización del cristal. Por ello, se considera que la exposición sucesiva a los factores predisponentes como: alimentos y bebidas ácidas, por largos periodos de tiempo, incrementará la erosión de la superficie dental7, provocando diferentes grados de erosión que pueden o no observarse clínicamente. Al respecto, Larsenet al., proponen un índice para la detección clínica de la erosión dental, que evalúa la profundidad y extensión de las superficies afectadas3.
Dependiendo de la idiosincrasia del individuo y de los factores de riesgo a los cuales se expone, se observará diferentes grados de erosión dental8. Los estadios más avanzados pueden presentarse con mayor disolución de los cristales de hidroxiapatita y exposición de la dentina y/o apertura del sistema tubular dentinario3,8. La apertura franca del sistema tubular a causa del proceso erosivo, puede provocar en el paciente hipersensibilidad dentinaria, descrita como un dolor breve y agudo ocasionado por la exposición de la dentina a estímulos térmicos, táctiles, osmóticos o químicos9.
El creciente número de pacientes con hipersensibilidad dentinaria ha generado la necesidad de estudiar diferentes tratamientos para disminuir o eliminar el dolor. Entre estos, los productos con alta concentraciones de fluoruros han demostrado tener un efecto positivo en el bloqueo de los túbulos dentinarios;sin embargo, tienen un efecto limitado sobre el alivio del dolor10. Kleinberg, por su partedemostró que la aplicación de una pasta que contiene bicarbonato de arginina y carbonato de calcio producía un alivio inmediato del dolor11.
El bicarbonato de arginina, destaca por su capacidad para obliterar la entrada del túbulo dentinario expuesto12. Este efecto es posible gracias a que sus componentes actúan como amortiguadores del pH, además la arginina es capaz de unirse a la dentina peritubular del conducto por diferencial de cargas y atraer iones de calcio a la zona expuesta, propiciando el sellado12.
Ante ambas opciones de tratamiento, en este trabajo se plantea como objetivo de estudio evaluar y describir los cambios estructurales de la superficie dental erosionada pre y post tratamiento con bicarbonato de arginina y monofluorofosfato de sodio, observados mediante microscopia electrónica de barrido.
El presente trabajo es un estudio piloto, de tipo descriptivo, transversal y casi experimental. La muestra de estudio estuvo conformada por los pacientes que asistieron a la Facultad de Odontología de la UCV durante el periodo enero – abril 2018, seleccionados a conveniencia por cumplir con los siguientes criterios de inclusión:
Fase Clínica: En esta fase se realizó la evaluación clínica de los pacientes para la selección de la muestra. Para ello, un examinador calibrado en el índice de erosión dental (Tabla I) propuesto por Larsenet al. 3 (Kappa intraexaminador: 0,75) realizó el examen clínico odontológico utilizando luz artificial, espejo plano, sonda O.M.S. y aire comprimido. Se seleccionaron cuatro (4) pacientes con edades comprendidas entre 18 y 25 años. De manera aleatoria y con enmascaramiento se le asignó a cada paciente el tratamiento a realizar luego de la primera cirugía; Grupo 1: dos (2) de los pacientes que utilizarían la crema dental Colgate® Sensitive Pro Alivio™ (ingredientes activos: bicarbonato de arginina 8% y compuesto insoluble de carbonato de calcio, con un contenido de flúor de 1450 ppm), y Grupo 2: dos (2) pacientes que utilizarían Colgate® máxima protección anticaries (ingredientes activos: monofluorofosfato de sodio 0.76% y fluoruro de sodio 0.1% con un contenido de flúor de 1450 ppm). A cada paciente se le indicó que debía cepillarse con el dentífrico proporcionado como lo hace de manera habitual y luego con el dedo índice, aplicar la crema directamente sobre la superficie vestibular de los terceros molares, realizando movimientos circulares durante un minuto, sin realizar enjuagatorios, dos veces al día, durante 14 días.
Fase Quirúrgica: A cada paciente se le fue realizada las exodoncias de los terceros molares en dos tiempos, Tiempo 0: exodoncia de los dientes ubicados en un lado de la boca, antes del tratamiento con el dentífrico y Tiempo post-tratamiento: exodoncia de los dientes ubicados en el lado contrario de boca, posterior al tratamiento con el dentífrico. Los dientes extraídos fueron lavados con solución fisiológica, secados con gasas y aire comprimido, y conservados en envases plásticos desinfectados y rotulados hasta su procesamiento.
Fase de Laboratorio: 14 dientes fueron recolectados para ser evaluados. Cada uno fue procesado hasta obtener un espécimen de la superficie vestibular de 5 mm de diámetro y 2 mm de espesor. Para ello, los dientes fueron incluidos en acrílico transparente y cortados empleando un microtomo con disco de diamante.

Análisis por Microscopía Electrónica de Barrido (MEB): Se realizó el montaje de cada muestra en un portaobjeto de aluminio de 1cm de diámetro, se fijó con cinta adhesiva doble faz y se colocó una pequeña cantidad de cemento de carbono en los extremos del espécimen.Posteriormente se procedió a realizar el laminado de oro por el principio de "sputtering" en el QUORUM Q150RS durante 10 minutos, en condiciones de bajo vacío con gas de argón para obtener un adecuado recubrimiento de la muestra 13. Las muestras fueron observadas en el microscopio electrónico de barrido marca QUANTA FEG 250, con un sistema de alto vacío para su análisis, utilizando una resolución de magnificación de 500x, 1700x, 2000x y 7000x.
Consideraciones Éticas: Este estudio recibió el aval del Comité de Bioética de la Facultad de Odontología de la UCV (Comunicación CB003/SI 2018).
La edad promedio de la muestra evaluada fue de 20,7 años. Todos los individuos refirieron consumir alimentos y bebidas ácidas con una frecuencia superior a 1 vez por día. El 100% de la muestra refirió presentar dolor por hipersensibilidad dentinaria en algún otro diente (no en el tercer molar), luego de la exposición al estímulo frío.
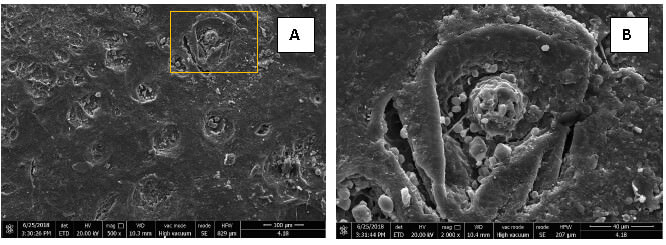
La evaluación clínica de la superficie vestibular de los terceros molares erupcionados mostró que el 50% de las superficies presentaban un índice de erosión grado 1, el 28,6% grado 2 y el 21,4% presentó grado 0. En la evaluación microscópica se observó que los segmentos de esmalte dental diagnosticados clínicamente con grado 1 de erosión, ya presentan exposición de algunos túbulos dentinarios en la superficie evaluada (Figura 1A) y cuando se incrementa la magnificación (Figura 1B, magnificación a 7000x del segmento señalado en el recuadro amarillo de la Figura 1A) es posible observar la pérdida del esmalte en la zona y la exposición de la dentina al medio. Los segmentos de esmalte diagnosticados clínicamente con erosión grado 2, al examen microscópico se observa la ausencia generalizada del esmalte y el puntillado característico de la dentina que corresponde con los túbulos dentinarios expuestos (Figura 1C magnificación de 1700x y Figura 1D magnificación de 7000x del segmento demarcado)

Los terceros molares provenientes de los pacientes evaluados clínicamente, que presentaron un índice de erosión dental grado 1 (Figura A y B) y grado 2 (Figura C y D) fueron seccionados hasta obtener un espécimen de la superficie vestibular, de 5 mm de diámetro y 2 mm un espesor empleando un micrótomo y discos de diamante. Las muestras fueron procesadas, fijadas, tratadas con recubrimiento de oro y observadas en el microscopio electrónico de barrido marca QUANTA FEG 250, con un sistema de alto vacío para su análisis, utilizando una resolución de magnificación de 1700x, 2000x y 7000x. Imágenes obtenidas en el tiempo 0 del estudio, en el Centro de Microscopia Electrónica “Dr. MitsuoOgura”, Facultad de Ciencias, UCV.
Para evaluar los posibles cambios estructurales asociados al uso de los tratamientos sugeridos para eliminar los síntomas de la hipersensibilidad dentinaria, a cada individuo de la muestra de estudio se le asignó de manera aleatoria el tratamiento a utilizar, Grupo 1: dos (2) pacientes que utilizaron la crema dental Colgate® Sensitive Pro Alivio™ (bicarbonato de arginina 8%) y Grupo 2: dos (2) pacientes que utilizaron Colgate® máxima protección anticaries (monofluorofosfato de sodio 0.76%).
Luego de 14 días de tratamiento, a cada paciente se le realizó la exodoncia de los dientes (Tiempo post tratamiento), se seleccionaron aquellos con diagnóstico clínico de erosión dental grado 1 y se procedió a evaluar la superficie vestibular por microscopía electrónica de barrido. En la Figura 2, se observa la imagen representativa del grupo 1, que corresponde con un segmento de la cara vestibular de los terceros molares tratados durante 14 días con una crema dental contentiva de bicarbonato de arginina al 8% y carbonato de calcio. En la imagen (Figura 2A) es posible observar la formación de una estructura mineralizada compacta que sella la entrada de los canalículos dentinarios. En la Figura 2B, se observa a mayor magnificación (7000x) la entrada del canalículo dentinario y es posible observar el proceso parcial de obliteración, esta imagen permite sugerir que la deposición de mineral ocurre de manera gradual y sucesiva en la entrada del túbulo dentinario.
Los terceros molares provenientes de los pacientes evaluados clínicamente, que presentaron un índice de erosión dental grado 1 fueron seccionados hasta obtener un espécimen de la superficie vestibular, de 5 mm de diámetro y 2 mm de espesor empleando un micrótomo y discos de diamante. Las muestras fueron procesadas, fijadas, tratadas con recubrimiento de oro y observadas en el microscopio electrónico de barrido marca QUANTA FEG 250, con un sistema de alto vacío para su análisis, utilizando una resolución de magnificación de 500x (Figura 2A) y 2000x (Figura 2B). Imágenes obtenidas en el tiempo post tratamiento del estudio, en el Centro de Microscopia Electrónica “Dr. MitsuoOgura”, Facultad de Ciencias, UCV.
En la Figura 3, se observa la imagen representativa del grupo 2, que corresponde con un segmento de la cara vestibular de los terceros molares tratados durante 14 días con una crema dental contentiva de monofluorofosfato de sodio 0.76% y fluoruro de sodio 0.1%, con un contenido de flúor de 1450 ppm. En la imagen (Figura 3A y 3B) es posible observar la formación de una capa globular, posiblemente de fluoruro de calcio, sobre el tejido dentinario que sella los túbulos dentinarios.

Los terceros molares provenientes de los pacientes evaluados clínicamente, que presentaron un índice de erosión dental grado 1 fueron seccionados hasta obtener un espécimen de la superficie vestibular, de 5 mm de diámetro y 2 mm de espesor empleando un micrótomo y discos de diamante. Las muestras fueron procesadas, fijadas, tratadas con recubrimiento de oro y observadas en el microscopio electrónico de barrido marca QUANTA FEG 250, con un sistema de alto vacío para su análisis, utilizando una resolución de magnificación de 2000x (Figura 3A) y 7000x (Figura 3B). Imágenes fueron obtenidas en el tiempo post tratamiento del estudio, en el Centro de Microscopia Electrónica “Dr. MitsuoOgura”, Facultad de Ciencias, UCV.
El presente estudio piloto fue realizado en una muestra conformada por cuatro (4) pacientes con hipersensibilidad dentinaria referida durante la anamnesis y algún grado de erosión clínica detectada en los terceros molares erupcionados, siguiendo los criterios de Larsen3. En total, catorce (14) dientes fueron evaluados por microscopia electrónica de barrido pre y posterior al tratamiento con dentífricos. Cabe destacar que el número de la muestra evaluada no permite la extrapolación de los resultados obtenidos.
En el presente estudio, el análisis por MEB mostró que las cremas dentales evaluadas fueron capaces de sellar la entrada de los canalículos dentinarios; sin embargo, la crema asignada al grupo 1, contentiva de bicarbonato de arginina al 8%, carbonato de calcio y 1450 ppm de fluoruro, claramente formó una estructura mineralizada que se depositó en la entrada de los canalículos dentinarios (Figura 2), logrando la oclusión de los mismos. Resultados similares fueron descritos por Petrouet al. 14, demostrando que la combinación de arginina y calcio a un pH alcalino, logra formar un aglomerado de arginina de calcio dentro del túbulo dentinario.
Otro estudio in vitro, realizado con especímenes de esmalte de bovino, desmineralizados con ácido (erosión ácida), fueron tratados con un dentífrico con arginina al 8% - carbonato de calcio o con monofluorofosfato de sodio. Los resultados indicaron que el ácido cítrico provocó una evidente rugosidad de la superficie del esmalte, el tratamiento posterior de los especímenes con arginina al 8%-carbonato de calcio y/o el dentífrico con monofluorofosfato de sodio, produjo la desaparición de los vacíos microscópicos observados en la superficie dental por MEB. Sin embargo, el análisis por espectroscopia electrónica Auger, demostró que los niveles de nitrógeno y carbonato, aumentaron a medida que se incrementó el número de aplicaciones del dentífrico con arginina, lo que evidencia que la misma y el carbonato de calcio se unieron a la superficie dental, y que las aplicaciones sucesivas pueden ser determinantes para la oclusión tubular 15. En nuestro estudio, la aplicación de la crema dental en la superficie vestibular de los terceros molares in vivo, solo se realizó durante 15 días, sería conveniente evaluar la superficie de estudio a diferentes tiempos de uso de los dentífricos.
Un estudio realizado por Lavender et al., mediante espectroscopia de electrones para análisis químico, demostró que la entrada de los túbulos obliterados contenía altos niveles de calcio, fósforo, oxígeno y carbonato. Además, confirmaron que la arginina se incorporó en el tapón de dentina resistiendo a desafíos ácidos 16. Para indagar sobre los cambios en la morfología de los túbulos dentinarios durante el tratamiento a corto plazo con productos desensibilizantes, empleando microscopía electrónica; Li et al. 17, recolectaron al azar terceros molares humanos recién extraídos y prepararon 40 discos de dentina que fueron tratados con diferentes dentífricos: grupo 1: 8% de arginina y carbonato de calcio, grupo 2: 10% de cloruro de estroncio y grupo 3: pasta remineralizante profesional (GC Tooth Mousse). El tratamiento se realizó 2 veces al día durante 10 días. Los resultados mostraron que todos los productos evaluados formaron una capa sobre la superficie de la dentina que redujo significativamente el diámetro de los túbulos 17. Resultados similares fueron descritos por Yang et al. 18, tras examinar la oclusión de los túbulos dentinarios en la dentina erosionada, luego de tratarse con bicarbonato de arginina al 8%. No obstante, Lopes et al., en su estudio comparativo, indicaron que sólo Sensodyne Repair & Protect, pudo promover la oclusión tubular de la dentina cuando se comparó ésta con Colgate Total 12 Clean Mint y con Colgate Sensitive Pro-Alivio que contiene arginina 19.
Considerando que la erosión dental frecuentemente es causada por la sucesiva exposición del diente a alimentos y bebidas ácidas, diferentes estudios han sido desarrollados para evaluar la eficacia de los productos desensibilizantes y remineralizantes cuando el diente es sometido a desafíos ácidos sucesivos. Al respecto, Davies et al. 20, empleando un modelo experimental in vitro de desmineralización, tratamiento y ataque ácido, probaron tres dentífricos, uno con arginina, un producto a base de estroncio y un dentífrico con fluoruro. Los resultados indicaron que las tres pastas desensibilizantes ofrecían una buena oclusión tubular. Sin embargo, después de la inmersión de los especímenes en ácido cítrico al 0,3%, durante 10 s, 30 s y 2 min, la crema dental contentiva de acetato de estroncio logró mantener la oclusión tubular en la superficie expuesta 20. Resultados similares fueron observados por Wang et al. 21; estos autores emplearon discos de dentina que trataron durante dos minutos con (1) control (agua destilada), (2) pasta de dientes no desensibilizante, (3) pasta de dientes Pro-Arginina, (4) pasta de Fosfopéptidos de Caseína (CPP-ACP), luego sumergieron los especímenes en saliva artificial durante 24 horas, para luego someterlos a desafíos ácidos y observarlos por MEB. Los resultados mostraron que Pro-Arginina y CPP-ACP, ocluyeron la mayoría de los túbulos de dentina. Sin embargo, esta oclusión se perdió luego del desafío ácido 21.
Es importante destacar que en el presente estudio piloto, los dientes permanecieron en la boca de los individuos durante el tiempo del tratamiento, por ende la superficie evaluada, estuvo sometida tanto a la desmineralización ácida por exposición a alimentos y bebidas con pH bajo, como a la remineralización llevada a cabo por el fluido salival y el tratamiento con cada dentífrico. Por ello, estos resultados, aunque no puedan ser extrapolados, representan una aproximación del efecto real de los productos desensibilizantes sobre una superficie dental expuesta al medio bucal real.
En relación a la crema dental con fluoruro, como ya se ha descrito, la misma es capaz de sellar la entrada de los canalículos dentinarios. Un trabajo realizado in vitro para evaluar el nivel relativo de oclusión del túbulo dentinario y la mineralización de la dentina conferida por el uso de pastas desensibilizantes versus un dentífrico fluorurado con 1450 ppm, mostró que la crema dental con fluoruro estañoso y el dentífrico con acetato de estroncio, brindaron el mayor nivel de oclusión después de cuatro días de cepillado dos veces al día, a pesar de los desafíos ácidos realizados durante dos días 22. El análisis microscópico indicó que la crema con fluoruro forma una capa distinta en la superficie de la dentina. También se demostró que las pastas dentales desensibilizantes pueden generar diferentes grados de oclusión tubular 22. Resultados similares fueron obtenidos en este estudio.
Dündar et al., señalan en su estudio, que el efecto in vitro del ácido cítrico modificado con caseína sobre el esmalte erosionado, es superior al obtenido con fluoruro y nano-hidroxiapatita. Los resultados de este trabajo indicaron que los especímenes tratados con caseína mostraron mayor recuperación del tejido, disminuyendo el grado de erosión 23.
Un estudio in situ, realizado por West et al.24, compara la eficacia contra la erosión dental, de un dentífrico con fluoruro de estaño al 0,445% frente a un dentífrico que contiene arginina. Para ello, los sujetos voluntarios usaron un dispositivo intraoral equipado con dos muestras de esmalte humano, durante 6 horas al día, empleando la suspensión de dentífrico asignada dos veces al día, además de beber 250 ml de jugo de naranja durante 10 minutos, cuatro veces al día. Los resultados determinados por perfilometría de contacto para medir la pérdida de la superficie del esmalte dental (al inicio y 10 días después), mostró que el dentífrico con fluoruro de estaño al 0.454% ofrece una protección a la erosión significativamente mayor en el esmalte humano frente a los desafíos del ácido erosivo, en comparación con el dentífrico que contiene arginina al 1.5% 24.Los fluoruros han sido estudiados por su capacidad anticariogénica; sin embargo, un trabajo in vitro realizado por Wang et al. 25, para evaluar el efecto protector del fluoruro y el galato de epigalocatequina (EGCG) contra la erosión dental inducida por los refrescos, mostró que ambos componentes ofrecen resistencia a la erosión en comparación el grupo control (agua destilada). Los resultados indicaron que logran mantener la microdureza del tejido y evitan la pérdida de sustancia mineralizada 25.
Por último, una de las consecuencias de la erosión dental es la hipersensibilidad dentinaria. La importancia clínica de este tipo de investigaciones supone brindar conocimientos para el manejo y control de dichos síntomas. Al respecto, uno de los aspectos más importantes a evaluar en el tratamiento de la hipersensibilidad, es el tiempo requerido para lograr la obliteración del conducto. Kleinberg 11 demostró que la crema dental con arginina producía un alivio inmediato del dolor causado por la hipersensibilidad dentinaria, luego de su colocación sobre la superficie dental, lo que sugiere que la oclusión tubular en el tejido dentinario se produjo de manera rápida, efecto que no se logra con la crema dental fluorurada, que requiere de varios días de tratamiento 11.
Los resultados obtenidos en este estudio piloto permiten concluir que el bicarbonato de arginina y el monofluorofosfato de sodio producen cambios estructurales en la superficie dental erosionada, capaz de sellar la entrada de los canalículos dentinarios.