Recibido para Arbitraje: 19/01/2019
Aprobado para su publicación: 15/02/2019
El crecimiento de las estructuras craneofaciales se da por interacción de factores genéticos, embriológicos, mecánicos y hormonales; dentro de este último, la hormona de crecimiento Somatotropina, tiene un rol fundamental. Los trastornos de crecimiento asociados con GH en niños que abarcan su déficit, el hipopituitarismo idiopático y algunos síndromes, presentan características que incluyen talla baja, acromicria y aspectos craneofaciales diferentes como apariencia facial inmadura y una longitud y profundidad de la cara pequeñas para la edad, que resultan en una convexidad facial infantil. También, una altura facial anterior aumentada, mayor retraso del crecimiento mandibular que del maxilar, ángulo goniaco más abierto y resultados inconsistentes para las alteraciones en la longitud y angulación de la base de cráneo. El tratamiento de trastornos de crecimiento asociados con el déficit de GH implica la administración de GH humana recombinante (rhGH) en dosis supra fisiológicas mediante inyecciones subcutáneas; mientras los efectos de esta terapia en el crecimiento de huesos largos y en la talla son relativamente bien entendidos, el conocimiento acerca de su efecto en el crecimiento óseo craneofacial aún no está claro. Se realizó una revisión de literatura para evaluar los reportes sobre el crecimiento craneofacial de pacientes tratados con rhGH. Se encontró que el crecimiento de algunas estructuras craneofaciales aumenta con el tratamiento y que los cambios en el maxilar y la base de cráneo son aún inconsistentes. Para la mandíbula se reporta un patrón más prognático, con rotación anterior por crecimiento principalmente de la rama mandibular.
Palabras clave: Hormona de crecimiento, crecimiento y desarrollo, anomalías craneofaciales, crecimiento craneofacial.
Growth of craniofacial structures is produced by the interaction of genetic, embryological, mechanical and hormonal factors with the growth hormone playing a significant role. Growth disorders associated to GH in children with GH deficit, idiopathic hypopituitarism and a few syndromes present some features, including low size, acromicria and different craniofacial characteristics, such as an immature facial appearance and unusually short facial length and depth that do not correspond to the actual age, which result in facial convexity. Also, other characteristics include an increased anterior lower facial height, a slower mandibular growth compared to the maxilla, an increased goniac angle and inconclusive results regarding length and angulation of the cranial base. Treatment of GH disorders associated to GH deficit implies the administration of recombinant human GH (rhGH) in supra-physiological doses through subcutaneous injections. Even though the effects of such therapy on the growth of long bones and the increase in size are well understood, its effects on growth of craniofacial bones is not clear. A literature review was performed to evaluate the reports on craniofacial growth of patients under rhGH treatment. It was found that some craniofacial structures increase their size, but changes in the maxilla and craniofacial base are still inconclusive. A more prognathic pattern has been reported in the mandible, including anterior rotation due to growth of the ramus.
Key words: Growth hormone, growth and development, craniofacial disorders, craniofacial growth.
Autor de correspondencia: Salazar Bedoya, Liseth Paola. [email protected]
El crecimiento de las estructuras craneofaciales se da por la interacción de factores genéticos, embriológicos, mecánicos y hormonales; dentro de este último, la hormona de crecimiento Somatotropina o GH por sus siglas en inglés (Growth Hormone), las hormonas tiroideas y los esteroides adrenocorticales y sexuales tienen un papel fundamental 1,2. La GH es una hormona producida por las células somatotropas de la hipófisis anterior o adenohipófisis bajo la influencia de hormonas hipotalámicas que afecta de forma directa el crecimiento craneofacial y la formación de los dientes y su erupción 1; todos estos mecanismos reguladores, incluyendo la GH, van a iniciar y dirigir el desarrollo óseo, el patrón de crecimiento, los cambios en talla y forma, y finalmente, la tasa de crecimiento de cada individuo por lo que una alteración en la producción o en la acción de alguno de ellos, dará como resultado un fenotipo corporal alterado 3.
Los trastornos de crecimiento asociados con la GH en niños incluyen su déficit o GHD por sus siglas en inglés (Growth Hormone Deficit), el hipopituitarismo idiopático y su relación con síndromes como Noonan, Prader Willi, Turner y Russell-Silver entre otros 4. El crecimiento craneofacial en sujetos con GHD fue descrito por primera vez como una apariencia de cara inmadura con una longitud y profundidad de la cara pequeñas para la edad que resultan en una convexidad facial infantil 1. Kjellberg y col. evaluaron la morfología facial y el desarrollo dental de pacientes con GHD y con Hipopituitarismo idiopático encontrando que el retraso en el crecimiento aplica tanto para las medidas corporales como para el crecimiento y desarrollo de la cara 3. Segal y col. sugieren que las personas con GHD no tratadas presentan características somáticas que incluyen estatura baja, acromicria y medidas craneofaciales diferentes5. Otros autores han evaluado las medidas cefalométricas de pacientes con GHD reportando que estos sujetos presentan una altura facial antero inferior aumentada y mayor retraso de crecimiento en la mandíbula que en el maxilar, un ángulo goniaco más abierto y resultados inconsistentes para la diferencia en la longitud y la angulación de la base de cráneo 3,5–7.
Actualmente el tratamiento en los diferentes diagnósticos que involucran retraso en el crecimiento implica la administración de hormona de crecimiento recombinante (rhGH) en dosis supra fisiológicas mediante inyecciones subcutáneas 5; mientras que los efectos de esta terapia en el crecimiento de los huesos largos y en la talla son relativamente bien entendidos, el conocimiento acerca de su efecto en el crecimiento óseo de otras regiones del cuerpo como el esqueleto craneofacial aún no está aclarado 8. Kjellberg y col. evaluaron los efectos a largo plazo de la terapia con rhGH en la morfología craneofacial de niños con baja estatura y encontraron que el crecimiento facial esquelético aumentó con el tratamiento en ciertas áreas indicando que los sitios de crecimiento craneofacial responden de manera similar al tratamiento al ser comparados con los del resto del cuerpo6. Estos mismos autores reportan que si bien en el área facial las medidas lineales parecen mejorar, la longitud del maxilar y la altura facial inferior se observan debajo de la norma, además, la mayoría de las medidas no se normalizan por completo 6 dejando vigente la controversia sobre su efecto en las estructuras craneofaciales. Sung-Hwan y col. evaluaron el efecto del tratamiento con rhGH sobre el crecimiento craneofacial concluyendo que en general aumentó hacia la norma, pero que algunas partes de la cara pueden estar influenciadas más allá de un crecimiento normal lo que puede conducir a un aumento exagerado de la mandíbula y a una cara más larga sugiriendo un uso cauteloso cuando se trate de niños con Hipopituitarismo idiopático 4. Numerosos estudios han documentado los efectos beneficiosos del tratamiento con rhGH en sujetos con GHD, sin embargo siempre ha existido la preocupación por el riesgo de desarrollar características de exceso de GH como aumento en el tamaño de la circunferencia de la cabeza, de las proporciones faciales y agrandamiento de las manos y de los pies 5.
La disponibilidad cada vez mayor de la terapia con rhGH en el tratamiento de varios tipos de trastornos del desarrollo trae consigo la necesidad de conocer sus efectos específicos en el crecimiento de las estructuras craneofaciales. Aunque se ha demostrado que existe una asociación entre el desarrollo craneofacial y el somático, la terapia con rhGH tiene un menor impacto en el esqueleto craneofacial cuando se compara con el resultado en la talla o en la maduración esquelética 8; la comprensión de los efectos de la terapia con rhGH en el crecimiento craneofacial es determinante puesto que en esta zona se da la interacción de varios sitios de crecimiento adyacentes cada uno con un patrón y un momento de crecimiento diferente. Además, para la práctica clínica de odontopediatras y ortodoncistas es indispensable conocer, evaluar, vigilar y controlar el crecimiento craneofacial no solo para establecer los objetivos terapéuticos sino también para predecir la estabilidad de los resultados durante la retención.
Los organismos muestran una gran variedad en el tamaño intra e inter especies secundaria a las modificaciones de los procesos de desarrollo en respuesta a variables ambientales y genéticas 9. El crecimiento humano desde la etapa de cigoto hasta su culminación en la adultez es un fenómeno complejo que implica una multitud de mecanismos reguladores que controlan la diferenciación y maduración tisular. Durante la infancia y la adolescencia las ganancias de altura y de peso son sensibles y se consideran índices de salud y bienestar 10. El crecimiento denota un aumento en el tamaño de los tejidos, mientras que el desarrollo especifica la maduración de las funciones. Los factores hereditarios, sexuales, metabólicos, sociales, emocionales y culturales, afectan directamente este proceso de crecimiento y desarrollo11, por esto, si el crecimiento fetal es alterado de manera pronunciada o prolongada se puede producir un retraso en el crecimiento al nacer y tener un impacto de por vida en el crecimiento posnatal, en las funciones cognitivas, endocrinas, metabólicas y cardiovasculares 12. La fase intrauterina de crecimiento está tipificada por la más alta tasa de crecimiento general y en especial para el complejo craneofacial, el recién nacido tiene una talla que es casi el 30% la del adulto, en cambio el cráneo tiene casi el 60%.12.
Los mecanismos que regulan el crecimiento y desarrollo del complejo craneofacial están determinados por interacciones complejas entre genes, hormonas, nutrientes y factores epigéneticos que le darán al hueso su forma final; cualquier perturbación de este mecanismo puede generar un patrón de crecimiento alterado 3,13. Aunque se ha establecido una asociación entre el desarrollo somático y el de la cara, el crecimiento de las estructuras craneofaciales se da de manera más compleja pues involucra la interacción de muchos sitios de crecimiento adyacentes, cada uno con un patrón y un momento de crecimiento diferente 14; así, se establece el gradiente de madurez del crecimiento craneofacial al considerar que el esqueleto de esta región expresa un patrón continuo de variación en su madurez que se manifiesta entre las estructuras como la madurez relativa en un momento dado 14.
En los procesos de condrogénesis y osificación del cartílago, que son determinantes en el crecimiento óseo, varias hormonas pueden actuar en vías paracrinas, endocrinas y autocrinas. Las hormonas que afectan el crecimiento incluyen a las tiroideas, las derivadas del eje adrenocortical, las hormonas sexuales y la GH; esta última, secretada por la glándula pituitaria, juega un papel importante el crecimiento longitudinal del hueso 15, además de estimular en el hígado la producción del factor de crecimiento similar a la insulina tipo 1 o Somatomedina C (IGF-1), encargado de estimular la actividad de osteoblastos y osteoclastos, la producción de colágeno tipo 1 y la mineralización ósea 7,16.
La GH es una hormona secretada por la hipófisis anterior o adenohipófisis para actuar directamente en los tejidos a través de receptores específicos o indirectamente a través de la producción de Somatomedina C (IGF-1). La teoría de la somatomedina introduce el concepto de que la GH influencia el crecimiento esquelético al estimular IGF-1, que a su vez induce el crecimiento óseo de forma endocrina, puesto que en los tejidos diana (sistema efector), interactúa con sus receptores específicos transmitiendo la señal de crecimiento a la célula ósea, además de ejercer un efecto negativo o feedback sobre la secreción de GH a nivel central (hipotálamo e hipófisis anterior) 17,18. El eje hormona de crecimiento-IGF-1-sistema efector consiste en una serie de circuitos hormonales que regulan el crecimiento somático; estos incluyen el hipotálamo, la hormona liberadora de hormona del crecimiento (GHRH) y su receptor, la GH y su receptor (GHR), IGF1 , su receptor (IGF1R) y sus proteínas de unión (IGFBPs) y la subunidad ácido-lábil (ALS), también están incluidos la somatostatina hipotalámica que es un inhibidor de la secreción de GH, y la grelina derivada del intestino que actúa como un estimulador de la secreción de GH19. Este eje es reconocido como un regulador clave del desarrollo musculo-esquelético normal; ante su falla, el fenotipo será una talla baja 20. Este eje también influye en el metabolismo óseo normal siendo un importante regulador del crecimiento posnatal en el proceso de modelado y remodelación esquelética orquestado por una interacción de factores de crecimiento locales, citoquinas y hormonas de las cuales GH y IGF-1 son componentes claves 14. Figura 1.
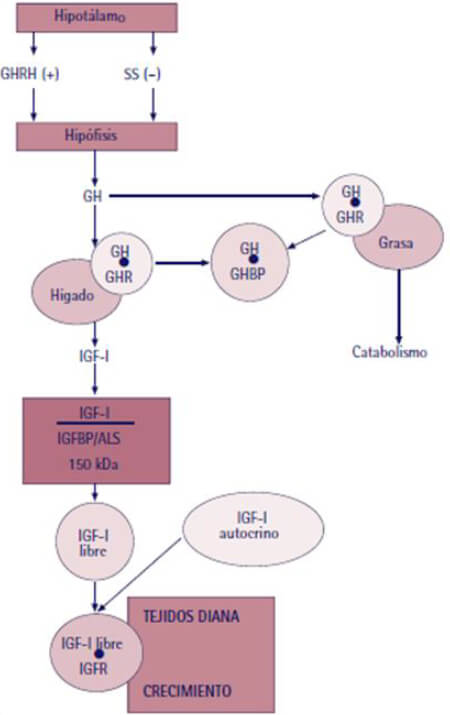
La GH es una proteína con 191 aminoácidos (22 KDa) sintetizada y secretada por las células del somatotropo en la hipófisis anterior al ser señalizado por la hormona hipotalámica liberadora de GH (GHRH) y dependiente del papel inhibitorio o no de la Somatomedina C1; aun considerando las muchas acciones que incluyen la regulación del crecimiento y el metabolismo óseo, su secreción es pulsátil con descargas que ocurren especialmente en las primeras horas de sueño y durante toda la noche a concentraciones dependientes de la edad, siendo baja durante la pre-pubertad y la senectud en tanto que es plena durante la pubertad. El somatotropo está adicionalmente influenciado para la liberación de GH por los esteroides sexuales y las hormonas tiroideas, mientras que los glucocorticoides a altas concentraciones lo inhiben; si bien la GH no tiene un órgano objetivo específico, es reconocida su acción sobre el hígado, el músculo, el riñón, el hueso y determinado impacto directo sobre el crecimiento craneofacial por efecto específico no solo sobre el cóndilo mandibular sino sobre el cartílago de la sincondrosis de la base de cráneo 14. Figura 2.

La GH es el principal regulador del crecimiento durante la infancia y la adolescencia y, dada su amplitud de pulsos, aumenta simultáneamente la tasa de crecimiento y las concentraciones plasmáticas de IGF-1 16; éste se encuentra en el plasma y otros fluidos biológicos formando complejos con proteínas transportadoras (IGFBPs) de las que se han descrito 6 tipos distintos (IGFBP-1 a IGFBP-6). Estas proteínas incrementan su vida media y modulan su biodisponibilidad en los tejidos blanco. Una de las principales proteínas de transporte es la subunidad ácido-lábil (ALS), una glicoproteína que se encuentra en la circulación y en otros fluidos corporales cuya síntesis se realiza principalmente en el hígado y se encuentra bajo el control estimulatorio de la GH. Los niveles de ALS son muy bajos en el nacimiento y aumentan a medida que se incrementa la síntesis hepática de la misma debido a la mayor capacidad de respuesta a la GH por un incremento en la expresión de sus receptores 21.
Tanto GH como IGF-1 son hormonas anabólicas con potencial para regular el modelado y la remodelación ósea; la primera estimula la proliferación, diferenciación y producción de procolágeno tipo 1, osteocalcina y fosfatasa alcalina en los osteoblastos, que además, responden expresando BMP 2 y 4 que unidas a sus receptores de superficie tanto en las formas progenitoras como maduras, desencadenan vías de señalización para promover la diferenciación de células osteoprogenitoras y para regular su propia actividad 14.
Teniendo en cuenta los efectos de GH sobre la formación y reabsorción ósea, se ha cuestionado en la literatura si ésta podría interferir en la remodelación ósea durante el movimiento dental; en un estudio experimental en ratas, Ribeiro y col.22 evaluaron el efecto de GH en el movimiento dental mediante la cuantificación de osteoclastos, lagunas de Howship y vasos sanguíneos del ligamento periodontal sugiriendo que la GH podría tener la capacidad de estimular la reabsorción y probablemente retrasar la formación de hueso nuevo como resultado de una vascularización disminuida concluyendo que la GH acelera la reabsorción ósea y retrasa la formación de colágeno inmaduro después del movimiento dental.
La GH influye principalmente en el crecimiento esquelético estimulando la diferenciación y proliferación de los condrocitos localizados en la placa de crecimiento 23. El cóndilo mandibular tiene un cartílago secundario de origen mesenquimal, que además de su origen embriológico, difiere de los cartílagos primarios encontrados en las placas de crecimiento y en la sincondrosis por su patrón de crecimiento y organización histológica puesto que sus capas superficiales comprenden un pericondrio en donde las células precondroblásticas se disponen al azar con poca organización estructural y secretan colágeno tipo I en lugar de tipo II y presentan un limitado potencial de crecimiento intrínseco con capacidad inferior de separación de tejidos al compararse con la sincondrosis y las placas de crecimiento de otros tejidos 24; dicho cartílago responde a factores hormonales y a cargas mecánicas, histológicamente tiene menos matriz extra celular, células de mayor tamaño y lenta maduración 25 que no desaparecen incluso después de su desarrollo completo por lo que puede readaptarse a diversas demandas funcionales 18.
La condrogénesis del cartílago condilar puede activarse con estímulos externos como el reposicionamiento mandibular, el cual genera diferenciación de células mesenquimales en la capa articular de los condrocitos que proliferan y maduran hacia células hipertróficas. Análisis genéticos han demostrado que GH e IGF-1 están presentes en las capas osteoprogenitoras y de condroblastos del cóndilo, encontrándose receptores de GH en varios componentes de la ATM, pero no en la superficie fibrosa articular ni en las capas de cartílago del cóndilo que, en cambio, presentan receptores para IGF-1, por lo que el crecimiento y el desarrollo postnatales tempranos del cartílago condilar mandibular parecen ser dependientes de IGF-1 y no directamente de la GH 26.
Ante exceso de GH, la síntesis local de IGF-1 es estimulada al igual que la actividad mitótica del cartílago endocrondral conduciendo a que sus células inmaduras incrementen la osificación y el crecimiento; por el contrario, la falta de GH disminuye la actividad mitótica15. Wang y col.27 en un modelo animal con ratas, evaluaron los efectos individuales y sinérgicos de la suplementación con GH y aparatos funcionales en el crecimiento mandibular y encontraron que los animales tratados en conjunto con GH y aparatología funcional presentaron mayor crecimiento mandibular, un cartílago más grueso y mayor expresión de metaloproteinasas matriciales 1 y 13 lo mismo que de colágeno de tipo II y X; para Feizbakhsh y col. 28 evaluando el crecimiento condilar generado tras la inyección local de GH humana en la ATM de conejos en un estudio experimental, el tratamiento fue capaz de acelerar el crecimiento del cartílago condilar.
El método diagnóstico más usado para evaluar la presencia de alteraciones en la secreción de GH es la medición en suero de los niveles de IGF-1. Para tener una adecuada interpretación de los resultados obtenidos, éstos deben ser considerados en función de factores inherentes a su propia fisiología 29. Las concentraciones de IGF-1 presentan variaciones en función de la edad, el sexo y el desarrollo puberal. En los primeros años de la vida sus concentraciones son muy bajas y aumentan progresivamente durante la infancia hasta presentar un marcado incremento en la pubertad. Las concentraciones de IGF-1 son más elevadas en el sexo femenino, sobre todo en la pubertad, adelantándose en 1-2 años al pico máximo observado para los hombres, debido fundamentalmente a las diferencias madurativas. Por el contrario, en adultos, el promedio de sus concentraciones es un poco más elevado en hombres que en mujeres 29. Así mismo, la concentración de IGF-1 presenta una variabilidad biológica intra-individual que puede fluctuar entre el 10% y el 36% en un periodo de 2 a 3 semanas en individuos sanos, por lo que el diagnóstico debería darse tras realizar varias mediciones de esta magnitud a lo largo de un periodo de tiempo determinado y no a partir de un único resultado puntual. A diferencia de las concentraciones de GH séricas, las concentraciones de IGF-1 son relativamente estables a lo largo del día. No presentan ritmo circadiano ni fluctuaciones significativas relacionadas con la ingesta de alimentos 29. Por último, el estado nutricional afecta considerablemente la concentración de IGF-1 y de algunas de sus proteínas transportadoras, en especial la proteína 1 enlazante del factor de crecimiento insulinoide (IGFBP-1). Ante malnutrición, ayuno prolongado o en estados catabólicos, diabetes mellitus descompensada, insuficiencia hepática o renal, se produce una resistencia a la acción de la GH que da lugar a que las concentraciones de IGF-1 estén disminuidas 29, al tiempo que las de GH basales y estimuladas son mayores. Se ha reportado que los pacientes con diabetes tipo I descompensada, tienen una concentración integrada de GH en 24 horas mayor, así como un aumento en la amplitud y en la frecuencia de los pulsos secretores de GH; se ha relacionado este aumento en la concentración sérica de GH con la disminución de IGF-1 que ejercería un menor efecto de control de la secreción de GH sobre la hipófisis 30.
Las alteraciones en la secreción de GH por exceso o por defecto causan trastornos en el crecimiento. El déficit en la secreción de GH retrasa el crecimiento somático y craneofacial presentando características que incluyen baja estatura, acromicria y cabeza más pequeña, con retrasos en general de todas las dimensiones craneofaciales lineales 5. La hipersecreción antes del cierre de las placas de crecimiento durante la adolescencia resulta en gigantismo y en la edad adulta en acromegalia31. El GHD, el hipopituitarismo idiopático y los síndromes como Noonan, Prader willi, Turner y Russell-Silver son condiciones que presentan un déficit de estatura como característica común acompañado de alteraciones en el crecimiento craneofacial 32.
Los niños con déficit de GH presentan perfiles convexos retrognáticos y un desarrollo dental retrasado 33. Cuando hay una híper secreción como en la acromegalia, el crecimiento mandibular gradual y las alteraciones hipertróficas en el cartílago condilar pueden manifestarse como prognatismo y mordida cruzada anterior 7.
Hodge y col.32 evaluaron las características oclusales de individuos con GHD, déficit de crecimiento idiopático y síndrome de Russell-Silver y las compararon con las de una población normal, encontrando que las alteraciones oclusales como la deficiencia transversal del maxilar, el apiñamiento y la sobremordida vertical aumentada fueron más prevalentes en los pacientes con alteraciones de crecimiento, especialmente para el grupo de niños con síndrome Rusell-Silver. Así mismo, Kumar y col.11 evaluaron y compararon la edad dental, la edad ósea y la edad cronológica en niños con baja estatura y encontraron que el retraso en la edad ósea y dental es una característica importante de los niños con estatura baja. También, Partyka y col.34 analizaron si los valores de edad esquelética y dental se ven afectados por el tratamiento con rhGH en pacientes con GHD por hipopituitarismo y encontraron que los niños con este diagnóstico tienen una edad esquelética y dental retrasada en función de la edad cronológica mientras que la edad dental del grupo control de pacientes sin alteraciones endocrinas se encontró adelantada con respecto a la edad cronológica.
Se han llevado a cabo estudios en animales para establecer si las alteraciones en la secreción de GH pueden relacionarse con alteraciones craneofaciales. Así, Ramirez-Yañez y col. 31 investigaron el efecto de la GH sobre el tamaño de las estructuras craneofaciales con tres modelos diferentes de ratones con un eje de GH alterado genéticamente, encontrando que la altura facial y la longitud del cuerpo mandibular se incrementaron significativamente en los ratones gigantes y se redujo igualmente de modo significativo en los ratones enanos: la longitud de la rama se vio afectada en los ratones enanos y no en los ratones gigantes en tanto que la longitud de los incisivos superiores se elevó en ratones gigantes versus una reducción significativa para los enanos; todo esto se acompañó de un ángulo de la mandíbula incrementado para los primeros y reducido para los segundos. Se concluyó que la GH juega un papel importante en el crecimiento y desarrollo del complejo craneofacial al modular directa e indirectamente el tamaño y las relaciones angulares de las estructuras craneofaciales, incluidos los dientes incisivos.
La deficiencia aislada de GH se define como una secreción de GH menor a los criterios estrictos 1. Las características clínicas varían con la etiología, edad de inicio y gravedad del trastorno; su origen puede ser hipofisario (primario), supra-hipofisario (secundario) o debido a una resistencia periférica a la GH, cuando la producción de GH sea normal o aumentada y ante una alteración del receptor de GH (síndrome de Laron) 35. Niños con GHD congénita tienen patrones de crecimiento característicos ya que muestran retrasos significativos en la maduración biológica esperada y disminución en el crecimiento somático 10; en general su peso y talla son normales al nacer y crecen adecuadamente durante los primeros 3 a 6 meses para luego desacelerar; resultan con una apariencia facial inmadura además de una profundidad y longitud de la cara disminuidas para la edad 10; presentan una altura y ancho facial disminuidos, circunferencia de la cabeza disminuida, sobresalen los huesos frontales, nariz en silla de montar, perfil convexo, disminución en la relación biparietal así como del ancho interorbital; cefalométricamente se describen con una rama corta y dimensiones disminuidas en la base de cráneo posterior lo mismo que del tamaño de los maxilares 14.
Salas-Flores y col. 36 en un estudio transversal de 46 pacientes, 23 con GHD en tratamiento y 23 sanos, evaluaron el crecimiento diferencial de las estructuras craneofaciales obteniendo no solo medidas disminuidas en los niños tratados para todas las estructuras faciales sino diferencias significativas en la longitud total de la mandíbula, la altura facial anteroinferior y la altura facial total, además de un tipo facial retrognatico. Para Oliveira-Neto y col. 1 en su estudio de características craneofaciales en un grupo homogéneo de adultos con GHD debido a una anormalidad genética y sin tratamiento, las medidas lineales especialmente la longitud del maxilar, seguido por la longitud de la base craneal posterior, la longitud mandibular total, la altura facial anterior y posterior, la longitud del cuerpo mandibular y la longitud de la base craneal anterior se reducen; además, reportan que las medidas menos afectadas fueron la altura facial anterior inferior y la altura de la rama mandibular, en tanto que las medidas angulares estaban en el rango normal a excepción del ángulo goniaco que se mostró aumentado; en sus conclusiones reconocen que la GHD congénita sin tratamiento reduce todas las medidas craneofaciales lineales, principalmente la longitud del maxilar.
En otro estudio transversal, Kellberg y col. 3 evaluaron la morfología craneofacial, la oclusión dental y la maduración y erupción dental en niños de estatura corta con GHD, reportando un retraso en el crecimiento de los maxilares que resultó en un tipo facial retrognático, una altura facial posterior más pequeña que la anterior y una rotación posterior marcada de la mandíbula, además de una demora en la madurez y erupción dental entre 1.2 a 1.3 años, demostrando que el retraso en el crecimiento aplica tanto para la altura del cuerpo como para el crecimiento y desarrollo de la cara y sugiriendo que las estructuras óseas que dependen del crecimiento cartilaginoso parecen ser más afectadas que las formadas por crecimiento sutural o por osificación intramembranosa.
Es la forma más común de GHD y se considera de etiología desconocida; puede tener carácter familiar o esporádico y la deficiencia de secreción de GH puede variar de moderada a grave; el rasgo clínico más característico es su profundo déficit de estatura, que oscila entre -4 y -11.5 desviaciones estándar por debajo de la media 10,35,37. Los niños presentan una serie de alteraciones que incluyen un retraso importante de la estatura, baja velocidad de crecimiento y retraso de la maduración ósea: la magnitud de estas manifestaciones está determinada por la duración y la gravedad del proceso; si bien la mayoría de los individuos tienen tamaño y peso normal al nacer, los parámetros antropométricos se alteran pronto y se transforman en un déficit marcado de crecimiento y desarrollo durante los primeros meses de vida: la velocidad de crecimiento (VC) está disminuida en un 50% durante el primer año y se establece en 2-3 centímetros por año en adelante; el fenotipo clínico es fácilmente identificable desde edades tempranas y la dismorfia craneofacial se presenta con disminución de las dimensiones longitudinales de la cara y con dimensiones craneales normales para la estatura de los sujetos; otras alteraciones propias son cabello escaso y frágil, frente prominente, puente nasal deprimido, facies y mandíbula pequeñas 35.
Por definición los niños se consideran pequeños gestacionales cuando las medidas de talla y peso al nacer están dos desviaciones estándar por debajo del referente poblacional con un parto prematuro o a término. La mayoría de los niños con PEG muestran suficiente crecimiento postnatal para normalizar su estatura a la edad de 2 años. Aproximadamente el 10% de los niños con PEG mantienen un tamaño corporal pequeño a lo largo de la infancia 38. Esta condición puede darse como consecuencia de factores fetales, maternos o ambientales, considerando también algunas causas como anomalías cromosómicas, alteraciones innatas en el metabolismo, infecciones y malformaciones, inserción anormal o infartos de la placenta, gestaciones múltiples y placenta previa, también, malnutrición, preclamsia, infecciones, entre otros. La falta de suministro nutricional para el feto se cree que es la causa principal de la reducción del crecimiento fetal 39. Se ha reportado un retraso en el crecimiento craneofacial de estos niños similar al de los que presentan deficiencia de GH que incluye base craneal posterior corta, mandíbula pequeña y retro posicionada y la altura facial disminuida 12.
El gen que codifica la GH (GH1) está en el brazo largo del cromosoma 17 (17q22-24), es conformado por cinco exones y cuatro intrones y el empalme correcto de éstos da como resultado la generación de un péptido con 22 KDa de longitud completa. Alrededor del 75% de la GH circulante se compone de los 22 KDa, mientras que el 5-10% consiste en un empalme que carece de los aminoácidos 32 y 46 (20 KDa) y entre un 1-5% se compone de 17 KDa que resulta de la omisión completa del axón 3 y carece de los aminoácidos 32 y 71. Las mutaciones homocigóticas o heterocigóticas en el gen GH1 conducen a varias formas genéticas de GHD 40.
Se estima que la morfología craneofacial es un rasgo poligénico cuantitativo que está determinado por factores genéticos y ambientales; al respecto, si bien estudios sobre la similitud de la morfología craneofacial entre parientes cercanos muestran que la influencia genética es determinante13 en lo particular, el gen del receptor de GH en su exón 10 (GHR) ha sido reconocido como posible candidato a determinar rasgos morfológicos para la altura de la rama mandibular en poblaciones de Japón y China13,41. Así mismo, Tobón-Arroyave y col42, evaluaron la asociación entre las variantes polimórficas rs6184 y rs6180 del gen GHR y el perfil esquelético-facial en una población Colombiana con un estudio transversal y encontraron que aunque los resultados no admiten que el polimorfismo único rs6180 en el gen GHR podría identificarse como un predictor para el perfil esquelético-facial, sugieren que el alelo A de rs6184 solo o en combinación con otros polimorfismos en el gen GHR podría explicar variaciones horizontales y longitudinales de la morfología mandibular.
Se contempla que el déficit de GH puede ser congénito y que a menudo ocurre por mutaciones; los genes más comunes implicados en su etiología genética son GH1 y el gen del receptor de la hormona liberadora de GH (GHRHR) aunque recientemente se han encontrado posibles nuevas causas, como las mutaciones en los genes GHSR, RNPC3 e IFT172 40,43,44. También se han reportado alteraciones en los genes que codifican a las proteínas que participan en la cascada de señalización del receptor de GH (como STAT5B), así como en los genes que codifican el propio IGF-1 (IGF-1), su receptor (IGF1R) y la subunidad ácido-lábil (ALS) 29. La deficiencia completa de ALS (ACLSD) resulta de una mutación inactivante en homocigosis en el gen IGFALS. La ACLSD se caracteriza por deficiencias severas de IGF-I e IGFBP-3, con niveles de ALS no detectables o cerca del límite de detección 21.
Starink y col. 45 evaluaron mutaciones en el gen IRF6 que regula la proliferación y diferenciación de las células epiteliales durante la formación de la línea media craneofacial en el desarrollo del embrión y concluyeron que los defectos IRF6 son raros en pacientes con déficit idiopático de GH y que la investigación actual debe centrarse en nuevos genes candidatos. Yamaguchi y col.46 evaluaron cuantitativamente la relación entre la morfología craneofacial y la variante Pro561Thr (P56IT) en el gen del receptor de la hormona del crecimiento en 50 hombres y 50 mujeres no relacionadas en una población japonesa y encontraron que la población normal sin P56IT tenía una longitud de rama mandibular significativamente mayor que aquellos con P56IT, sugiriendo que la variante P56IT del gen GHR puede estar asociada con crecimiento de la altura de la rama mandibular y puede ser un marcador genético para ello. Por otro lado, Dias y col 20, evaluaron el posible papel del gen GHR en el déficit de crecimiento idiopático mediante el examen de dos tipos diferentes de polimorfismos genéticos y hallaron una asociación significativa de un micro satélite GT en el promotor de GHR con déficit de crecimiento idiopático.
El objetivo principal es conseguir una normalización de la talla lo más pronto posible, con el empleo de hormona de crecimiento artificial elaborada bajo procesos biotecnológicos que generan un compuesto lo más parecido a la hormona natural con capacidad de incrementar el desarrollo adecuado de los huesos y músculos 15. Actualmente el tratamiento para la deficiencia de GH implica la aplicación de GH humana recombinante (rhGH) en dosis supra fisiológicas, aproximadamente representativas de 0.3mg/kg/semana en inyecciones subcutáneas 5; la dosis y la edad del niño determinan en gran medida la respuesta al tratamiento y su eficacia dado que no solo una mayor dosis con una menor edad influencian un mejor crecimiento sino su continuidad a largo plazo (varios años) 12.
El catch-up growth (recaptura de talla) se define como la recuperación de la tasa de crecimiento después de la eliminación de una condición inhibitoria del crecimiento; se ha sugerido que esta recuperación puede ocurrir por dos vías: en la primera, el individuo muestra aceleración temprana del crecimiento que disminuye el déficit de talla rápidamente, en tanto que con la segunda, el individuo permanece en un percentil inferior de crecimiento durante años y crece a una velocidad normal hasta más allá del periodo habitual18.
El tratamiento con rhGH ha mostrado una influencia positiva en el crecimiento tanto a corto como a largo plazo; la talla aumenta hacia la normalidad durante la terapia y sigue siendo estable después de su interrupción, tanto que se puede observar en ocasiones una mejora clínicamente relevante de la altura adulta 38,39. Zegher y col. 38 evaluaron la efectividad de la suplementación con rhGH en niños PEG, relacionando los efectos con la dosis y el tiempo de tratamiento y reportaron que esta suplencia es un enfoque efectivo en el manejo del déficit de estatura en niños PEG además de reconocer que la ganancia de altura es menos dosis dependiente a largo que a corto plazo.
Con base en estudios de pacientes adultos con déficit de GH se propone un modelo de acción bifásico de la rhGH en la remodelación ósea: en primer lugar se sugiere que la administración inicial de ésta aumenta la resorción ósea con pérdida ósea neta, para luego incrementar la formación de hueso a los 12 a 18 meses después del tratamiento, con un punto de transición de 6 meses en el que la formación de hueso se da a un ritmo mayor que la reabsorción 18.
No obstante sus beneficios, se han identificado algunos efectos adversos en el tratamiento con rhGH como cefalea, problemas visuales, náuseas, vómito, retención de líquidos, artralgias, mialgias, parestesias y reacciones en el sitio de la inyección 47.
Algunos autores han evaluado el efecto de la terapia con rhGH en el crecimiento de las estructuras óseas craneofaciales con resultados diversos. Arends y col.48 investigaron los efectos del tratamiento con rhGH contra ningún tratamiento en el perímetro cefálico (PC) y las proporciones corporales de niños PEG, encontrando que tras 3 años de tratamiento se indujo un crecimiento proporcional que dio como resultado no solo la normalización de la talla y de algunas medidas antropométricas sino también del PC, en contraste con los sujetos no tratados. Van Erum y col. 12, evaluaron el efecto del tratamiento con altas dosis de rhGH en el crecimiento craneofacial de 21 niños pre púberes sin deficiencia de GH y nacidos pequeños para la edad gestacional; al comienzo del estudio, todos los niños mostraron un retraso general de crecimiento craneofacial, disminución del ángulo SNB (medida angular formada por Silla-Nasion-punto B) e incremento del ángulo ANB (medida angular definida por punto A-Nasion_punto B) y con las demás medidas angulares dentro del rango normal; pero tras el uso de rhGH se aceleró el crecimiento en varios componentes craneofaciales, especialmente en la altura facial posterior total, la longitud de la base craneal y la longitud total de la mandíbula; el aumento de la longitud mandibular mejoró el ángulo SNB sin afectar ninguna otra medida angular; se sugiere por los autores que el tratamiento con altas dosis de rhGH durante 2 años conduce a una recuperación del crecimiento craneofacial, pronunciado en las regiones en las que está involucrado el cartílago intersticial y generando un perfil facial menos convexo.
Kellberg y col. 6 evaluaron 48 pacientes tratados con rhGH y lo compararon con un grupo control de referencia de 130 niños sanos, clase I, de 7 a 21 años, con relaciones transversales y verticales normales, sin asimetría y sin tratamiento de ortodoncia. Se tomaron radiografías cefálicas al inicio y al final del periodo de seguimiento encontrándose que el tratamiento con rhGH genera crecimiento del esqueleto craneofacial con normalización de un 71% de las variables cefalométricas evaluadas; se observó una mandíbula más prognática con rotación anterior lo que sugiere que en los niños con talla baja el tratamiento con rhGH ejerce una influencia favorable en el patrón de crecimiento craneofacial.
De faria y col. 7 llevaron a cabo una observación prospectiva en dos grupos durante un período no inferior a 3 años del efecto de la rhGH sobre el crecimiento craneofacial y de las extremidades; en el grupo 1 se incluyeron los pacientes con hipopituitarismo sin tratamiento previo de rhGH que pasaron a ser tratados por 3 años; al grupo 2 ingresaron los pacientes con hipopituitarismo en tratamiento de rhGH previo al estudio, con una duración promedio de tratamiento de 6,5 años. Se encontró que el grupo 1 mostró una diferencia estadísticamente significativa en la base posterior de cráneo, la mandíbula y el tercio inferior de la cara, demostrando un mayor efecto de rhGH sobre la base de cráneo posterior, tercio inferior de la cara y mandíbula en los pacientes que iniciaron el tratamiento durante el estudio, lo que sugiere que la estimulación del crecimiento craneofacial se produce durante los primeros años de tratamiento.
Por otro lado, Segal y col. 5 usando antropometría (morfometría facial, fotografías frontales y laterales) y datos de referencia de edad y sexo como control en 12 sujetos con déficit de GH sin tratamiento y estableciendo comparación con 52 sujetos con GHD en tratamiento, concluyeron que los sujetos tratados con dosis convencionales corrigen parcialmente los déficits craneofaciales sin afectar negativamente el crecimiento de manos y pies, pero dando lugar a crecimiento excesivo del PC.
Choi y col.4, evaluaron el efecto del tratamiento con rhGH sobre el crecimiento craneofacial en niños con déficit idiopático en comparación con niños diagnosticados con deficiencia demostrada de GH, indicando en su reporte que durante el tratamiento la longitud maxilar aumentó más de lo esperado en ambos grupos y que la altura de la rama mandibular, la longitud del cuerpo y la longitud total de la mandíbula aumentaron más en las niñas con déficit de crecimiento idiopático que en las niñas con déficit demostrado de GH.
Fanatsu y col. en un estudio transversal15 determinaron el efecto de la terapia con rhGH en el crecimiento craneofacial de niños con déficit de GH, mediante la comparación a corto y largo plazo de 57 pacientes representativos de 3 grupos (no tratamiento, corto plazo, largo plazo): sus resultados precisan que después de la administración de rhGH los puntajes de desviación estándar para las medidas N-ENA (medida lineal entre punto Nasion y espina nasal anterior) y Co-Go (medición lineal entre los puntos Condileon y Gonion) aumentaron significativamente, sugiriendo que la terapia aceleró el crecimiento del cartílago; en consecuencia, el crecimiento óseo intramembranoso, incluido el de la sutura y el del cartílago de crecimiento, no solo se comportan con aceleramiento sino que la terapia a largo plazo (más de 2 años) genera aumento en el crecimiento craneofacial especialmente del maxilar y la mandíbula; en conclusión, el uso de rhGH acelera el desarrollo craneofacial, mejora la oclusión y el perfil facial de los pacientes.
Juloski y col. 49 en un estudio transversal con 13 niñas Turner con edad promedio de 17,3 años, evaluaron la influencia de la terapia con rhGH a largo plazo sobre la morfología craneofacial tras ser medicadas durante mínimo dos años, comparándolas con grupo control de 13 pacientes Turner sin tratamiento y emparejadas por edad y cariotipo: sus resultados muestran que el uso de rhGH incrementa la mayoría de las mediciones lineales en las niñas tratadas. En tal caso, la terapia con hormona de crecimiento influyó principalmente en la altura posterior de la cara, la altura de la rama mandibular, la longitud total de la mandíbula, la altura de la cara anterior y la longitud maxilar; si bien el aumento en las mediciones lineales fue evidente, las medidas angulares y la relación de altura facial no mostraron diferencias estadísticamente significativas. En otro estudio, este mismo autor 50, valorando los cambios del complejo craneofacial de 15 pacientes con síndrome de Turner tratadas con hormona de crecimiento durante el desarrollo (reconocidas como prepúberes e intrapúberes con pico de crecimiento) y a quienes califica sus etapas de maduración por el método de valoración de vértebras cervicales CVM por sus siglas en inglés (Cervical Vertebral Maduration), estima que la tasa de crecimiento y el patrón de las estructuras craneofaciales se deben emplear para establecer los efectos de la rhGH en el desarrollo craneofacial, sugiriendo que en las niñas tratadas las capacidades de crecimiento de la base craneal y del maxilar, además de ser adecuadas, son dependientes del uso de rhGH.
Finalmente, De Souza y col.51 evaluaron las características faciales de pacientes con síndrome Prader-Willi con y sin tratamiento con rhGH reportando que la terapia tiene un efecto correctivo en el crecimiento facial vertical pero no en la forma de la cara, en la orientación característica de los ojos y en la forma de la nariz, que en conjunto, se conservan invariables.
Los efectos de la suplementación con GH en el crecimiento de las estructuras craneofaciales también han sido estudiados en modelos animales.
González y col. 9 evaluando en ratones el papel del momento y la dosis de GH sobre el crecimiento y los cambios de forma de los huesos craneofaciales (diseño longitudinal, ratones con deficiencia de GH tratados antes y después de la pubertad), encontraron que los niveles variables de GH circulante alteraron el tamaño y la forma del cráneo adulto, comportándose como influyente sobre la base del cráneo, la bóveda y la cara de manera diferente: mientras que las sincondrosis craneales y las suturas faciales fueron susceptibles al efecto directo o indirecto de la suplementación con GH, su efecto fue insignificante en la bóveda craneal; por otro lado, el momento del tratamiento con GH no tuvo un efecto en la recuperación del crecimiento.
Así mismo, Singleton y col. 8 utilizando una cepa mutante de ratas Lewis en la que exclusivamente solo se encuentran valores de GH representativamente bajos (6% al 10% del valor promedio normal), investigaron la susceptibilidad diferencial de las medidas craneofaciales ante la suplementación con GH, caracterizando su potencial de crecimiento como parcial o completo; de sus resultados se desprende que las diferencias de crecimiento fueron evidentes entre los grupos tratados y los controles no tratados, pero el efecto del tratamiento varió inversamente con la madurez relativa de la medida evaluada: a pesar de que todas las medidas craneofaciales mostraron cierta recuperación del crecimiento solo el 31% tuvieron una recuperación completa en comparación con las medidas de las extremidades; en conjunto, los efectos de la suplementación con GH varían considerablemente de modo que las medidas con madurez relativa más baja muestran el mayor efecto de tratamiento y recuperación, mientras que las medidas más maduras muestran una menor respuesta de crecimiento al tratamiento.
El tratamiento con rhGH resulta en un incremento favorable del crecimiento de las estructuras craneofaciales mostrando mayores cambios cuando el inicio del tratamiento es temprano y en especial durante el primer año de tratamiento.
Las medidas craneofaciales que muestran mayor respuesta con la suplementación de rh-GH son la altura posterior y anterior de la cara, la altura de la rama mandibular, la longitud total de la mandíbula y el ángulo SNB.
Clínicamente los cambios craneofaciales en pacientes tratados con rh-GH favorecen principalmente el desarrollo mandibular, mostrando una mejoría del perfil facial con una disminución del retrognatismo y del tipo esquelético clase II, dada principalmente a expensas de un crecimiento marcado de la rama mandibular así como de una rotación anterior de la misma.