Recibido para arbitraje: 20/03/2021
Aprobado para su publicación: 15/04/2021
Objetivo: El objetivo del presente trabajo es describir un caso de fibroma ameloblástico (FA) recidivante y su manejo, así mismo analizar las causas de tal recidiva. Descripción del caso: Se describe a continuación un caso de FA en paciente joven de 21 años, género femenino, manejado conservadoramente y con una evolución de postoperatorio inmediato y mediato de 2 años satisfactorios. Se presenta (después de 5 años del diagnóstico inicial) con una recidiva importante, motivo por el cual debe emplearse un tratamiento más radical y posterior reconstrucción mandibular. Conclusiones: El FA es una neoplasia odontogénica que, a pesar de ser benigna, puede presentar un comportamiento agresivo, con una tasa de recurrencia y transformación maligna elevada; por ello se sugieren tratamientos más radicales para su manejo y seguimiento detallado a largo plazo.
Palabras clave: fibroma ameloblástico, recidiva, tumor benigno, tumor odontogénico, reconstrucción mandibular.
The objective of this study is to describe a case of recurrent ameloblastic fibroma (AF) and its management, as well as to analyze the causes of such recurrence. Case presentation: A case of AF in a young 21-year-old female patient, managed conservatively and with a satisfactory immediate and mediate postoperative evolution of 2 years is described below. It presents (5 years after the initial diagnosis) with a significant recurrence, which is why a more radical treatment and subsequent mandibular reconstruction should be used. Conclusions: AF is an odontogenic neoplasm that, despite being benign, may present an aggressive behavior, with a high rate of recurrence and malignant transformation; for this reason, radical treatments are suggested for its management as well as detailed long-term follow-up.
Key words: ameloblastic fibroma, recurrence, benign tumor, odontogenic tumor, mandibular reconstruction.
Autor de correspondencia:
Mariana Villarroel-Dorrego. ORCID: 0000-0002-0596-1527
Instituto de Investigaciones Odontológicas. Universidad Central de Venezuela
[email protected] +58- 212 6053778
Los autores declaramos no tener ningún conflicto de intereses.
El fibroma ameloblástico (FA) descrito por primera vez por Kruse en 1981, representa el 2% de los tumores odontogénicos1. Se describe como un tumor odontogénico benigno, mixto, de rara aparición2. Afecta principalmente al género masculino y tiene predilección por la primera y la segunda década de la vida. Más del 80% de los casos son localizados en mandíbula, específicamente en región posterior3.
Clínicamente, se presenta como una tumefacción de crecimiento lento e indoloro, generalmente diagnosticado como hallazgo durante una revisión dental4. Sin embargo, se han informado presentaciones iniciales con dolor moderado2,3. El retraso en la erupción dental también puede ser un signo inicial de FA3,4. Imagenológicamente, es una lesión completamente radiolúcida y bien definida2.
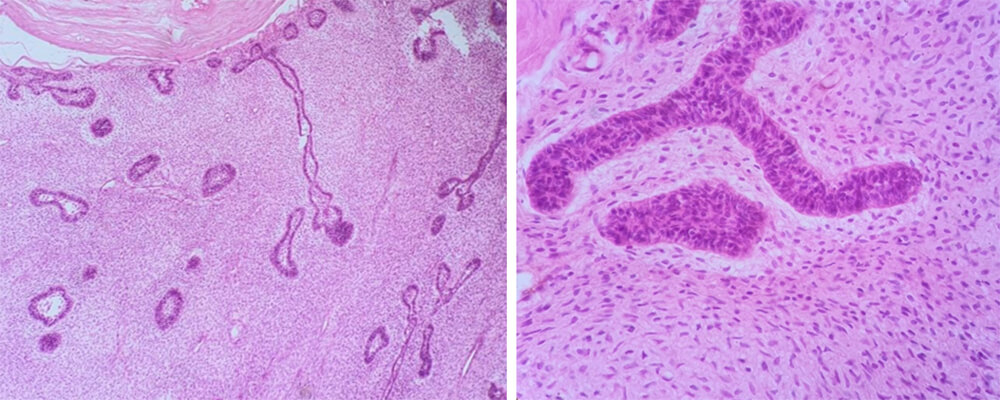
La OMS5 los describe como neoplasias compuestas de proliferaciones de epitelio odontogénico incrustado en un tejido celular ectomesenquimático que se asemeja a la papila dental, y con diversos grados de cambio inductivo, por lo que histológicamente se presenta como una mezcla de componentes epiteliales y mesenquimales.
La cirugía conservadora primaria con enucleación y legrado es generalmente la opción en edades tempranas6. En cuanto a los pacientes adultos, se debe considerar una cirugía radical cuando el tumor es de gran tamaño o cuando ha recidivado inclusive una vez7,8.
Tradicionalmente, los FA se consideran tumores no agresivos. Por lo general, se piensa que la recurrencia está relacionada con tumor residual debido a una extirpación incompleta. Sin embargo, las únicas series de casos amplias reportadas indicaron una tasa alta de recurrencia de 36,4% y 43,5% respectivamente y no se encontró evidencia estadísticamente significativa de que la recurrencia sea ocasionada por tumores residuales9. Es por esto que los FA pueden ser más agresivos de lo que se consideraba anteriormente y dependiendo del caso se deben realizar resecciones en bloque.
El presente trabajo tiene como objetivo describir un caso de FA recidivante por un curso agresivo del tumor, sin evidencia de transformación maligna o cambios en la celularidad del mismo.
Se trata de paciente femenino de 21 años, sin antecedentes médicos contributorios quien inicia enfermedad actual en el año 2013 por presentar aumento de volumen en región submandibular izquierda con dolor moderado y espontáneo.
En ortopantomografía se observa imagen radiolúcida de bordes definidos, que se extiende distal a la superficie radicular de órgano dental 34, extendiéndose hacia la región posterior involucrando cuerpo, ángulo y parte de la rama mandibular izquierda, con rizálisis de órgano dental 35, 36 y 37 (figura 1).
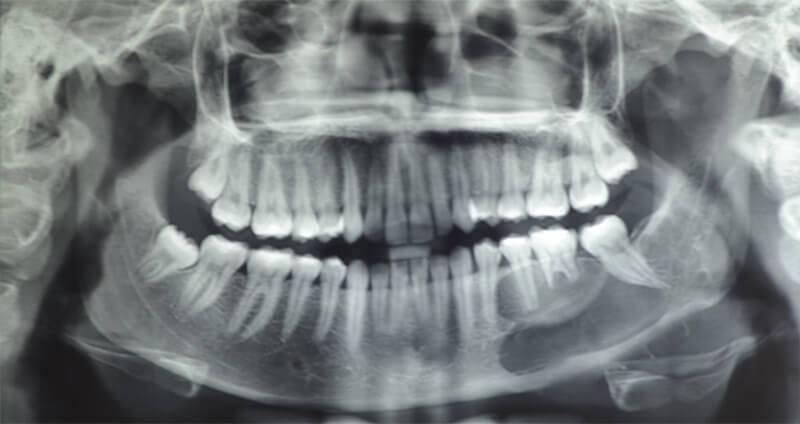
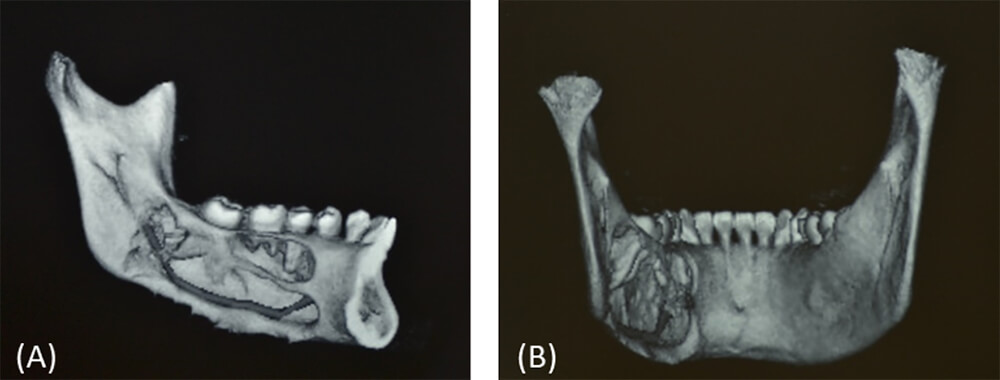
En tomografía computarizada de cortes axiales, sagitales y coronales más reconstrucción volumétrica se evidencia imagen hipodensa, multilocular, de límites definidos, bordes parcialmente corticalizados, que se extiende desde la superficie radicular distal del órgano dental 34 hasta la superficie radicular distal del órgano dental 37, que compromete rama mandibular, basal mandibular ipsilateral, con reabsorción radicular de OD 35 y 36 y desplazamiento caudal del conducto mandibular (figura 2).
El examen clínico arrojó pruebas de vitalidad negativa en los órganos dentales 35 y 36 asociados a la lesión. El diagnóstico presuntivo planteado fue ameloblastoma, sin embargo, estas características se corresponden con diagnósticos diferenciales que incluyen mixoma odontogénico, queratoquiste odontogénico, fibroma ameloblástico y granuloma central de células gigantes, entre otros.
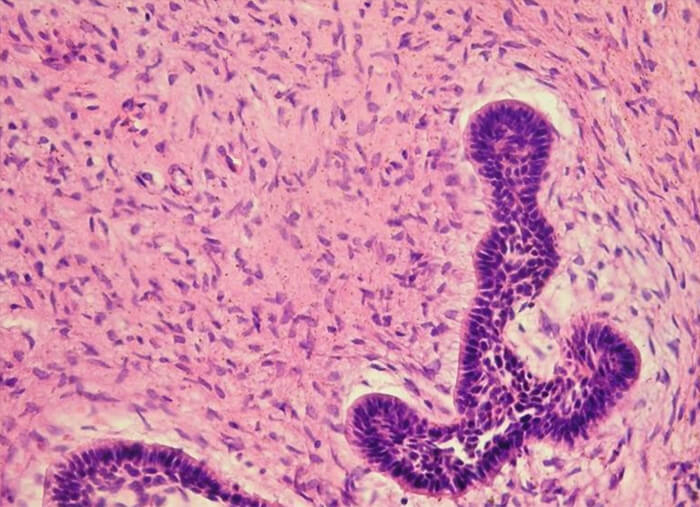
Bajo sedación endovenosa y anestesia local infiltrativa se realizó abordaje intraoral para enucleación y curetaje de lesión osteolítica en cuerpo mandibular izquierdo, exodoncia de órganos dentarios involucrados (figura 3) y envío de biopsia para estudio histopatológico, el cual arrojó como conclusión diagnóstica FA (figura 4). La paciente cursa con una evolución satisfactoria posterior a los 2 años de cirugía (figura 5).
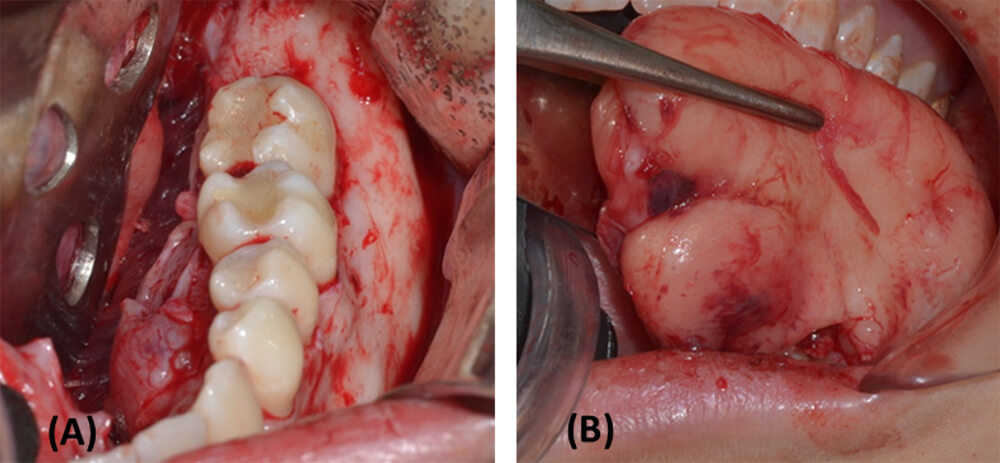
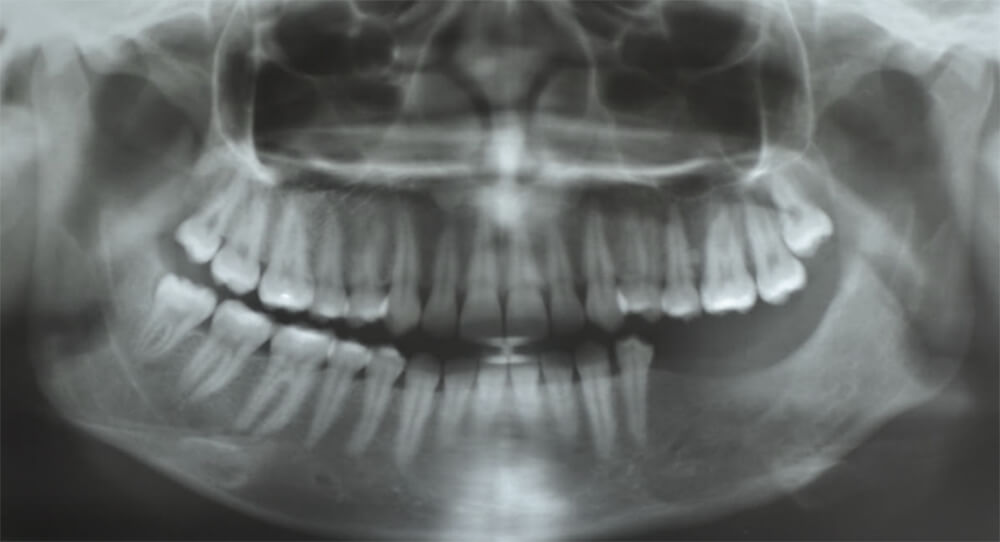
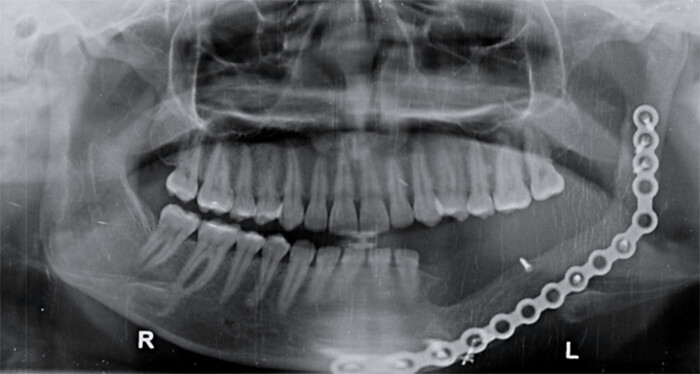
Cinco años más tarde (año 2018) la paciente asiste a consulta presentando dolor intenso, espontáneo, en región de piso de boca izquierdo y dolor intenso a la palpación profunda. Se le indica ortopantomografía donde se evidencian múltiples imágenes radiolúcidas en cuerpo, ángulo y rama mandibular izquierda (figura 6). Se indica tomografía computarizada para planificación de intervención quirúrgica.
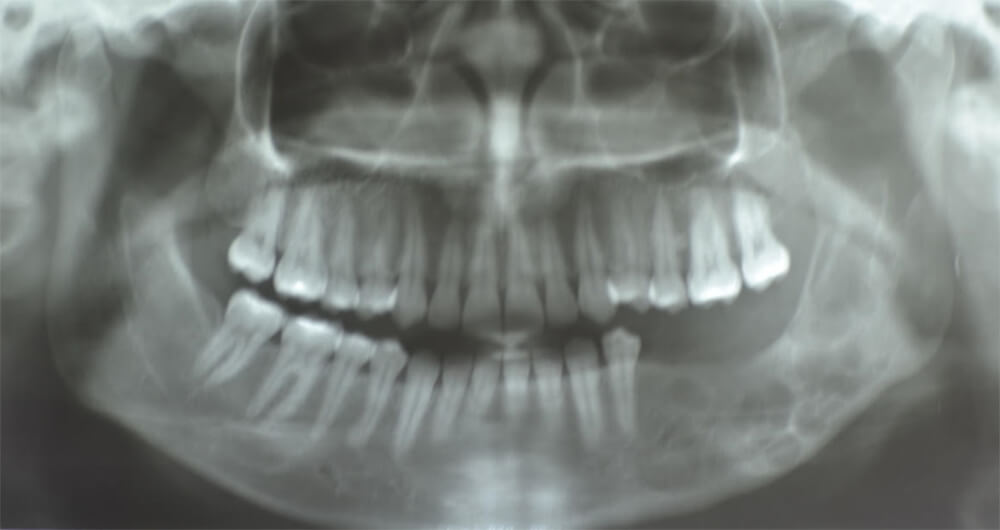
En la tomografía computarizada de cortes axiales, sagitales y coronales más reconstrucción volumétrica, se aprecian múltiples imágenes hipodensas, multiloculares que se extienden en cuerpo, ángulo y rama mandibular izquierda (figura 7).
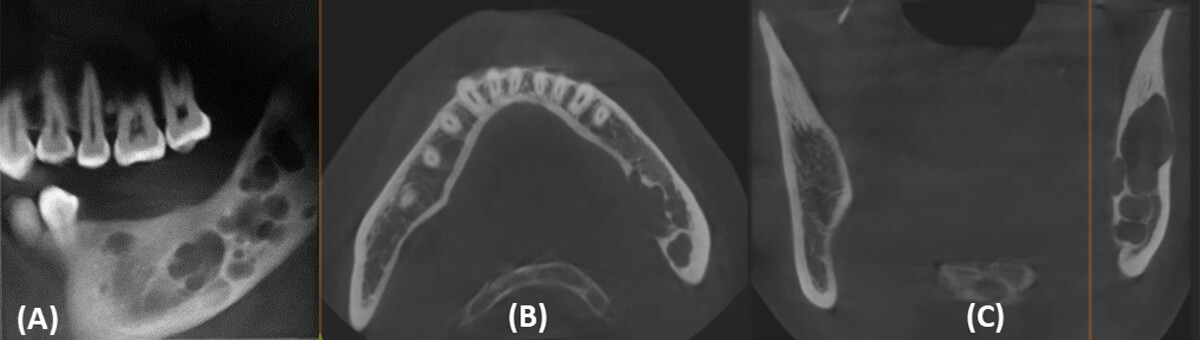
La paciente es llevada a mesa operatoria y bajo anestesia general inhalatoria balanceada, se realiza infiltración anestésica con lidocaína al 2% más epinefrina 1: 100.000 para abordaje intraoral con incisión circunvestibular mandibular izquierda, levantamiento de colgajo mucoperióstico de espesor total desde la región de la sínfisis hasta la rama mandibular ipsilateral, disección roma hasta la basal mandibular y borde posterior de la mandíbula para exposición quirúrgica de toda la lesión.
Posteriormente se procede a la colocación de la placa de reconstrucción mandibular del sistema 2.7 pre-contorneada y fijación de ésta con 6 tornillos bicorticales, 3 tornillos en el segmento proximal y 3 en el segmento distal. Diseño de osteotomía para resección en bloque desde órgano dental 33 con preservación de cóndilo mandibular, dejando márgenes de seguridad de 2 cm a cada lado de la lesión y obtención de espécimen para estudio histopatológico (figura 8).
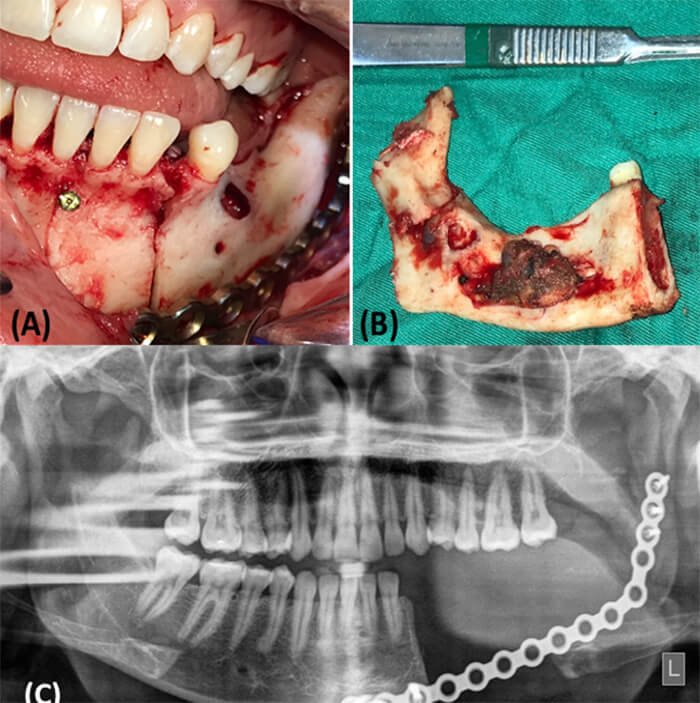
Se envía espécimen para estudio histopatológico que confirma el diagnóstica de FA recidivante (figura 9), con márgenes óseos libres de lesión de hasta 2cm.
La paciente se mantiene en controles postoperatorios con evolución satisfactoria y en planificación para reconstrucción mandibular. En 2019 es llevada a mesa operatoria bajo anestesia general inhalatoria balanceada y a través de abordaje extraoral submandibular izquierdo se realiza reconstrucción mandibular con injerto autólogo tomado de cresta ilíaca izquierda fijado con tornillos de sistema 2.4 a la placa de reconstrucción mandibular colocada en el procedimiento anterior más la colocación de fibrina rica en plaquetas. (figura 10).
El FA es un tumor benigno inusual, generalmente diagnosticado como hallazgo imagenológico. Por su ubicación y características pueden realizarse diagnósticos diferenciales con múltiples patologías como ameloblastoma, mixoma, queratoquiste odontogénico entre otros3,8,9.
Actualmente hay controversias sobre la evolución del FA. Cahn y Blum8 propusieron la "teoría de la maduración"; la cual establece que FA es la etapa inicial de una misma lesión que se convierte en fibroodontoma ameloblástico (FOA) y finalmente en odontoma. Esto ha sido controversial, debido a que el FA suelen aparecer en las mismas etapas etarias. También se han reportado formas recidivantes de FA de larga data sin evolución a odontoma6 como en el caso presentado.
En cuanto al comportamiento biológico de la lesión, anteriormente era considerada un tumor poco agresivo, inocuo y por ello se propone inicialmente un manejo conservador9,10. Sin embargo, algunos autores establecen que se trata de un tumor con comportamiento invasivo y que requiere una terapia más radical en base a la recurrencia y la transformación de los casos reportados en la literatura10.
La enucleación simple se relaciona con una tasa de recurrencia considerable del FA, hallazgo similar al observado en otros tumores odontogénicos11. Esto apoya también el hecho de que el FA es más agresivo de lo que se pensaba anteriormente y se necesita entonces un tratamiento menos conservador para su tratamiento12-15.
El diagnóstico de fibrosarcoma ameloblástico se realiza histológicamente. El componente mesenquimal del FA puede mostrar una progresión gradual a características malignas16. Se han descrito casos de transformación maligna de FA y FOA en fibrosarcoma ameloblástico (un 44% de los fibrosarcomas descritos)6. Tales lesiones se caracterizan por un aumento de celularidad, polimorfismo nuclear y actividad mitótica del componente mesenquimatoso3,6. Muller et al.7 reportaron que el 44% de los fibrosarcomas ameloblásticos tenía un diagnóstico previo de FA, por lo tanto, presenta una tasa de transformación elevada6,11,12,16-18. La mayoría de las transformaciones malignas se observan en el grupo de mayor edad y la mayoría de las recurrencias aparecen en el grupo de edad más joven16-18.
La desaparición gradual del componente del epitelio en algunos fibrosarcomas ameloblásticos recurrentes se ha utilizado para la estadificación del tumor, pero el reducido número de casos notificados es un factor limitante importante. Se necesitan más estudios para confirmar si un componente epitelial dominante es un signo de buen pronóstico11,12.
La evaluación del potencial proliferativo de los FA mediante los marcadores inmunohistoquímicos ayuda a comprender la agresividad tumoral y facilita una adecuada planificación quirúrgica19. Esta herramienta puede ser sumamente útil para definir el comportamiento biológico de la lesión y el tratamiento más adecuado.
Estudios de inmunohistoquímica de marcadores proliferativos, que incluyen antígeno nuclear Ki67 y PCNA, fueron reportados como herramientas útiles para identificar potencial crecimiento y malignidad. Un alto índice de Ki67 indica mayor posibilidad de recurrencia, por lo tanto, un seguimiento a largo plazo es imperativo19. Sano et al.20 describió índices elevados de MIB-1 en el componente mesenquimatoso del FA recurrente y del fibrosarcoma ameloblástico. Estos hallazgos indican que la evaluación del potencial de crecimiento del FA podría ayudar a comprender la agresividad del tumor y así seleccionar los procedimientos quirúrgicos apropiados.
Igualmente, la expresión del gen BRAF ha sido descrita en FA21, mutación observada en un alto porcentaje de ameloblastomas mandibulares5, lo cual sugiere una alteración genética similar de pudiera imitar el patrón de crecimiento y agresividad de estas neoplasias.
El FA es una neoplasia odontogénica benigna con alta posibilidad de recidiva. Se sugiere que un enfoque de resección marginal o en bloque con márgenes de seguridad debe indicarse en pacientes con lesiones multiloculares o extensas y en casos recurrentes. Los tratamientos conservadores para el FA no deberían ser considerados como el tratamiento e elección ideal. Es sumamente importante no subestimar esta neoplasia y mantener un seguimiento a largo plazo, considerando largo plazo más de 20 años de control.